|
 |
| Korean J Vet Res > Volume 61(2); 2021 > Article |
|
Abstract
Biosilica is a silica-based substance derived from the cell walls (frustules) of diatoms. Recently, research into biosilica’s biological functions is underway, but little has been reported on the effects of biosilica on immune cells. In this study, we investigated the effect of ionized biosilica water (iBW) on dendritic cells (DCs), which play crucial roles as antigen (Ag)-presenting cells. Treatment with iBW increased the expression of immune response-related markers, closely connected to the maturation of DCs, and the production of tumor necrosis factor-alpha. In addition, iBW-treated DCs (iBW-DCs) had a lower uptake of fluorescein isothiocyanate-dextran than that of control DCs. Mixed leukocyte response analysis used for measuring the Ag-presenting capability of DCs, showed iBW-DCs had a higher capability than that of control DCs. Interestingly, DCs treated with lipopolysaccharide (LPS) and iBW had a lower level of Ag-presenting capability than that of LPS-treated DCs. Taken together, the results indicate that iBW alone can mature DCs, but it decreases the Ag-presenting capability of DCs in the presence of LPS, a representative agent of inflammation. This study may provide valuable information regarding the effect of iBW on immune cells. Further research is needed to investigate how iBW induces the observed biphasic immunomodulatory activity.
규조류(Diatoms)는 “frustules”라고 하는 다공성 규산질 세포벽으로 덮인 단세포 광합성 조류이다[1]. 바이오실리카(biosilica)는 규조류의 세포벽에서 추출된 물질이며 합성 실리카(synthetic silica, 이하 실리카)와 화학적 구성성분이 SiO2로 같지만 실리카와는 다른 생물화학적 활성을 가지고 있다[2].
바이오실리카는 뼈조직에서의 조직공학, hemorrhage control, silica-based drug delivery system 등 생의학 분야에서의 적용이 연구되고 있다[1-4]. 하지만 면역세포에 대한 바이오실리카에 대한 연구는 매우 제한적이고 주로 실리카와 실리카 nanoparticle에 대한 연구가 보고되었다[5, 6]. 실리카는 pathogen-associated molecular pattern으로 인식되어 면역세포를 자극할 수 있으며, 대식세포의 사이토카인 생산을 촉진하였다[5]. 또한 실리카 성분의 nanoparticle에 대한 독성에 대해 보고된 바 있다[6]. 실리카에 대한 면역세포의 반응은 물리 화학적 성상과 세포의 종류에 따라 반응성이 달랐다[6].
항원 제시 세포(antigen presenting cells, APC)는 면역계의 주요 세포로서 면역반응에 필수적이다[7, 8]. 그 중 수지상세포는 선천면역(innate immunity)과 적응면역(adaptive immunity)에서 항원 특이적인 면역반응의 개시, 면역 관용 등을 담당하는 핵심적인 면역세포이다[9]. 수지상세포는 각종 장기에 분포하며 주로 미성숙(immature) 형태로 존재하면서 외부에서 침입하는 항원, 병원체를 만나면 탐식하고 주변의 림프절로 이동하여 림프구를 활성화시킨다[10].
본 연구에서는 바이오실리카를 정제수에 녹인 형태의 농축된 이온화 규소수(ionized biosilica water, iBW)가 면역기능에 어떤 영향을 미치는지 알아보기 위해, 면역 중심 세포인 수지상세포에 처리하여 세포대사 및 기능에 대한 효과를 알아보았다.
실험동물은 OrientBio (Korea)에서 제공받아 제주대학교 실험동물센터에서 유지하였으며, 8-12주령의 C57BL/6와 Balb/c 마우스를 실험에 사용하였다. 동물실험은 제주대학교 동물실험윤리위원회의 승인 하에 시행하였다(승인번호, 2020-0034). iBW는 JDK 바이오사(Korea)에서 제조된 SIEAUNET 알파 이온화 규소수®를 사용하였다. 배양된 규조류(Melosira nummuloides)를 650-850℃에서 회화공정을 하여 유기물이 완전히 제거되고 얻어진 바이오실리카를 원료로 하였으며, 이전 실험에서 사용된 규소수보다 10배 진한 농도이며 이온화 상태이다. 정제수를 사용하여 용해한 규소수(SiO3, pH 8-9)이며, 실험 전에 0.2 μm 필터를 거친 뒤 사용하였다. Lipopolysaccharide (LPS; Sigma-Aldrich, USA)는 수지상세포를 자극하는 양성 대조 물질로 사용하였다.
수지상세포는 본 실험실에서 확립된 방법으로 준비하였다. 수지상세포를 배양하기 위해 C57BL/6 마우스의 대퇴골과 경골에서 골수세포를 얻었다[11]. 적혈구를 제거한 후 10 ng/mL의 mouse recombinant granulocyte macrophage-colony stimulating factor (Peprotech, USA)와 murine interleukin (IL)-4 (Peprotech)가 포함된 배지에서 배양하였다. 림프구와 과립구를 최대한 배제하기 위해 배양 시작 후 2일과 4일째에 부유세포를 제거하였고 바닥에 붙어있는 수지상세포의 전구세포를 배양하였다. 6일 후 반부유된 세포를 수지상세포로 사용했다.
수지상세포의 대사활성도를 측정하기 위해 세포를 2 × 105 cells/mL의 농도로 96-well culture plate에 분주하였다. iBW를 농도 별로 처리하여 3일간 배양하였다. 그 후, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT, Sigma-Aldrich) 용액을 0.5 mg/mL의 농도로 처리하여 4시간 동안 배양하고 10% sodium dodecyl sulfate 용액을 처리 후 2시간 동안 배양하였다. Microplate reader (Multiskan FC; Thermo Fisher Scientific, USA)를 이용하여 570 nm에서 흡광도를 측정하였다.
수지상세포를 2 × 105 cells/mL의 농도로 96-well culture plate에 넣은 후, iBW를 농도별로 처리하였다. 3일간 배양한 후 세포 배양 상층액을 분리하였고, enzyme-linked immunosorbent assay (ELISA) kit (Thermo Fisher Scientific)를 이용하여 IL-1 beta와 tumor necrosis factor (TNF)-alpha의 생산량을 측정하였다. ELISA 분석은 제조사의 실험 방법에 따라 진행되었으며, 450 nm에서 흡광도를 측정하였다.
수지상세포의 면역 관련 마커의 발현 정도를 측정하기 위해 표면 마커에 특이적인 단클론항체를 이용하여 유세포 분석을 실행하였다. 수지상세포를 6-well culture plate에 분주한 후, iBW와 LPS를 처리하여 3일간 배양하였다. 세포염색은 fluorescein isothiocyanate (FITC)-labeled anti-mouse MHC class Ⅱ (I-Ab)와 phycoerythrin (PE)-labeled anti-mouse CD40, PE/cyanine7-labeled anti-mouse CD54, allophycocyanin (APC)-labeled anti-mouse CD86 항체(Biolegend, USA)를 사용하였다. 또한 수지상세포의 항원 탐식능을 측정하기 위해 100 μg/mL 농도의 FITC-dextran을 세포에 처리한 후 37℃에서 1시간 반응시켰다. 모든 분석은 FACSCalibur flow cytometer와 CellQuest software (BD Biosciences, USA)를 이용하였다.
C57BL/6 마우스 유래의 수지상세포를 6-well culture plate에 넣은 후, 5% 농도(volume/volume, v/v)의 iBW와 0.1 μg/mL 농도의 LPS를 처리 후 2일간 배양하였다. 혼합 배양 기간 동안 수지상세포의 성숙으로 인한 오차 발생을 방지하기 위해 수지상세포를 50 μg/mL 농도의 mitomycin C로 30분간 처리하였다. 실험실에서 확립된 방법에 따라 Balb/c 마우스에서 비장세포를 얻어[12], 수지상세포와 각각 2 × 106 cells/mL, 1 × 105 cells/mL의 농도로 96-well culture plate에 넣은 후 5일간 배양하였다. 수지상세포에 의해 자극된 림프구의 증식 및 활성을 측정하기 위해 10 μL/well의 cell counting kit-8 (CCK-8) 용액(Dojindo Molecular Tech., Japan)을 처리하고 37℃에서 4시간 동안 배양한 후, microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다.
수지상세포의 활성도에 대한 iBW의 효과를 알아보기 위해 MTT assay를 시행하였다. 수지상세포에 iBW를 0-5% 농도(v/v) 범위에서 2배 계단 희석하여 3일간 처리하였다. LPS를 처리한 군과 처리하지 않은 군 모두에서 대조군(0%)에 비해 경미한 감소를 보였지만 유의하지 않았다. 또한 농도별 차이도 보이지 않았다. LPS를 처리하지 않은 군은 LPS 처리군에 비해 모든 농도에서 대사활성도가 낮았다(Fig. 1).
iBW를 처리한 수지상세포의 IL-1 beta와 TNF-alpha의 생산량을 ELISA를 통해 정량하였다(Fig. 2). IL-1 beta의 생산량은 LPS에 관계없이 낮은 농도(0.3125%, 1.25%)에서는 약간 감소하고 5%의 농도에서는 대조군과 유사했다. 하지만 모두 대조군과 큰 차이를 보이지 않았다. TNF-alpha 생산량은 LPS를 처리했을 때, IL-1 beta와 마찬가지로 낮은 농도에서는 감소하였으나 5%의 농도에서는 유의하게 증가하였다. LPS가 없을 때는 0.3125% 이하의 농도에서는 측정 범위 이하였으며, 5%의 농도에서는 유의하게 증가하였다.
iBW가 수지상세포의 활성화와 성숙을 유도하는지 알아보기 위해 수지상세포의 면역 관련 표면 마커의 발현을 측정하였다. iBW는 수지상세포의 표면 마커 발현을 크게 증가시켰는데, MHC class Ⅱ의 경우 대조군에 비해 약 39% 증가하였고, 나머지 3개 마커는 50% 이상의 증가율을 보였다(Fig. 3). 수지상세포를 활성화시키는 양성 대조군으로 쓰인 LPS보다는 발현 정도가 낮았다. 4개의 표면 마커 모두에서 LPS와 iBW를 모두 처리한 세포(이하 LPS/iBW-dendritic cell [DCs])는 LPS를 단독으로 처리한 세포(이하 LPS-DCs)보다 약간 증가하였다.
iBW가 수지상세포의 성숙을 유도하는지 알아보기 위해 항원 탐식 분석을 하였다. 세포는 FITC-dextran과 함께 37℃에서 1시간 동안 배양되었다. 4℃의 수지상세포는 음성 대조군으로 이용되었다. iBW가 처리된 세포(이하 iBW-DCs)와 LPS-DCs, LPS/iBW-DCs 모두 대조군보다 FITC-dextran 탐식 정도가 감소했다(Fig. 4). iBW-DCs가 가장 낮았고, LPS/iBW-DCs가 LPS-DCs보다 높았다.
비장세포의 대사활성도를 측정하여 수지상세포의 림프구 자극 능력을 분석하는 MLR을 하였다. 수지상세포는 5% iBW와 0.1 μg/mL LPS를 2일 동안 처리해서 Balb/c 마우스로부터 얻은 동종이형 비장세포와 1:20의 비율로 co-culture를 하였다. 5일 후 CCK-8 assay를 통해 림프구의 대사활성도를 측정하였다(Fig. 5). 모든 처리군에서 대조군에 비해 림프구의 대사활성도가 증가하였는데, iBW-DCs에서는 유의하지 않았다. LPS/iBW-DCs는 LPS-DCs보다 림프구 대사활성도가 유의하게 감소하였다.
바이오실리카는 다양하게 생의학적 응용 가능성이 제시되고 있으며[1], 실리카와 화학적 성분은 동일하지만, 서로 다른 생리활성 특징을 보이는 것으로 알려져 있다[2]. 골활성물질과 함께 사용되거나 약물전달체로 적용 가능성 등이 연구되어 왔으며[3,4], 지혈효과에 대한 연구도 진행된 바 있다[2]. 바이오실리카는 다양한 생리활성 기능에 대한 연구에도 불구하고, 바이오실리카가 면역계에 노출되었을 때 면역세포에 대해 어떤 효과가 있는지에 대한 연구는 매우 미흡한 실정이다. 본 연구에서는 이온화되어 이전보다 10배가 농축된 iBW의 면역기능에 대한 효과를 알아보기 위해, 수지상세포에 iBW를 처리하여 세포 활성도, 사이토카인 생성량, 면역 관련 표면 마커의 발현, 항원 탐식 능력, 항원 제시 능력을 확인하였다.
이번 연구에서 iBW는 0-5%의 농도 모두에서 대사활성도가 크게 감소하지 않았다. 농축되지 않은 규소수(biosilica water)를 사용했던 이전 실험에서는 20% (v/v)의 농도에서 대조군에 비해 대사활성도가 유의하게 감소했다[13]. 이 결과는 iBW가 이전의 규소수보다 10배 농축된 물질임에도 불구하고 수지상세포의 대사활성도에는 크게 영향을 미치지 않음을 보여준다.
표면 마커 분석 결과는 iBW가 미성숙한 수지상세포를 성숙시켜 면역작용을 활성화할 수 있다는 것을 보여주었다. iBW는 수지상세포의 MHC class Ⅱ 분자와 3개의 면역 관련 분자들의 발현을 모두 증가시켰다. iBW-DCs는 LPS-DCs보다 낮은 수준이었지만, LPS/iBW-DCs가 LPS-DCs보다 마커 발현이 더욱 증가한 것으로 보아 iBW가 단독으로도 수지상세포를 성숙시켜 면역반응을 증가시킬 수 있음을 보여준다.
활성화된 수지상세포는 사이토카인을 분비하여 항원 특이적 기억 T 세포나 naïve T 세포를 자극하고 면역반응을 촉진한다[9,10]. IL-1 beta와 TNF-alpha는 활성화된 수지상세포에서 분비되는 염증반응을 촉진하는 사이토카인(inflammatory cytokine)이며, 세포 매개 면역반응에 관여한다[14]. iBW를 처리한 수지상세포가 IL-1 beta와 TNF-alpha를 얼마나 생산하는지 알아보았다. 0.3125%와 1.25% iBW처리군은 IL-1 beta는 모든 농도에서 대조군에 비해 유의한 변화는 없었던 반면, TNF-alpha는 5% iBW를 처리했을 때 대조군에 비해 유의하게 증가하였다. 이는 5% 이상의 상대적인 고농도에서 iBW가 단독으로 수지상세포를 자극하여 활성화할 수 있음을 보여준다.
iBW가 수지상세포를 성숙시키는지 알아보기 위해 항원 탐식 능력 분석도 시행하였다. 미성숙 수지상세포는 주로 항원을 탐식하지만 성숙한 수지상세포는 미성숙 수지상세포와 비교해 항원 탐식 능력이 낮다[9, 15]. iBW-DCs, LPS-DCs, LPS/iBW-DCs 모두에서 대조군보다 FITC-dextran 탐식 정도가 감소했다. 이는 iBW가 수지상세포를 성숙시킬 수 있다는 것을 의미한다. 하지만 LPS-DCs에 비해 LPS/iBW-DCs의 탐식 능력이 더 높아진 것을 확인했다. 향후 LPS 처리된 또는 염증 시 iBW가 수지상세포의 phagocytosis 등의 항원 탐식 능력에 대해 미치는 영향에 관한 세밀한 연구가 필요하다.
수지상세포의 항원 제시 능력에 대한 iBW의 효과를 알아보기 위해 동종이형 혼합 림프구 반응 시험(mixed leukocyte response, MLR)을 수행하였다. MLR 분석에서 수치의 증가는 수지상세포에 의해 자극된 동종이형림프구의 대사활성도 증가와 증식(proliferation)을 의미한다[16]. 대조군 수지상세포에 비해 iBW-DCs의 항원 제시 능력이 증가된 사실을 확인했다(Fig. 5). 반면 LPS-DCs에 비해 LPS/iBW-DCs의 항원 제시 능력은 감소하였다. 이는 iBW가 단독으로는 수지상세포의 항원 제시 능력을 증가시키지만, LPS와 같은 염증성 물질의 존재 하에서는 수지상세포의 항원 제시 능력을 감소시킬 수 있음을 보여준다.
본 연구에서는 iBW는 단독으로 수지상세포를 활성화하고 성숙시킬 수 있으며, LPS와 같은 염증성 물질이 있을 때는 수지상세포의 항원 제시 능력을 낮추어 면역조절 기능을 할 수 있다는 것을 확인했다. 따라서 iBW는 단독 또는 염증상태에서 면역 중심 세포인 수지상세포에 대해 서로 다른 반응(biphasic effect)을 보였다. 하지만 LPS-DCs에 비해 LPS/iBW-DCs에서 수지상세포 표면의 면역 관련 분자의 발현 증가, TNF-alpha의 생산 증가가 나타나는 사실은 항원 제시 능력의 증가와는 차이가 있다. 향후 연구를 통해 iBW에 의한 면역 관용 유도, 관련 분자의 발현이 어떻게 변하는지를 밝힐 필요가 있다.
Acknowledgments
이 논문은 2020년도 정부(산업통상자원부)의 재원으로 한국산업기술진흥원의 지원을 받아 수행된 연구임(N0002327, 2020년 산학융합지구 조성사업).
Fig. 1.
Effect of ionized biosilica water (iBW) on the metabolic activity of dendritic cells (DCs). DCs were cultured in 96-well culture plates at a concentration of 2 × 105 cells/mL with 0 to 5% (v/v) iBW and 0.1 μg/mL lipopolysaccharide (LPS) for 3 days. MTT assays were performed as described in Materials and Methods. The optical density (OD) was measured at 570 nm by using a microplate reader.
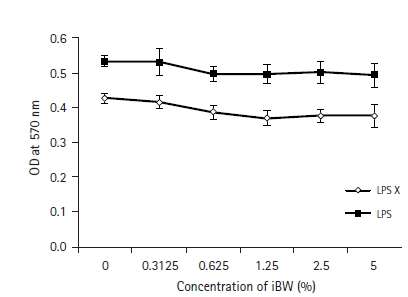
Fig. 2.
Effect of ionized biosilica water (iBW) on the production of interleukin (IL)-1 beta and tumor necrosis factor (TNF)-alpha. Dendritic cells (DCs) were cultured in 96-well culture plates at a concentration of 2 × 105 cells/mL with 0 to 5% (v/v) iBW and 0.1 μg/mL lipopolysaccharide (LPS) for 3 days. The supernatants of the cultured DCs were collected and used for enzyme-linked immunosorbent assay. The optical density was measured at 450 nm by using a microplate reader. Data are presented as mean ± standard deviation. *p < 0.05, ***p < 0.001.
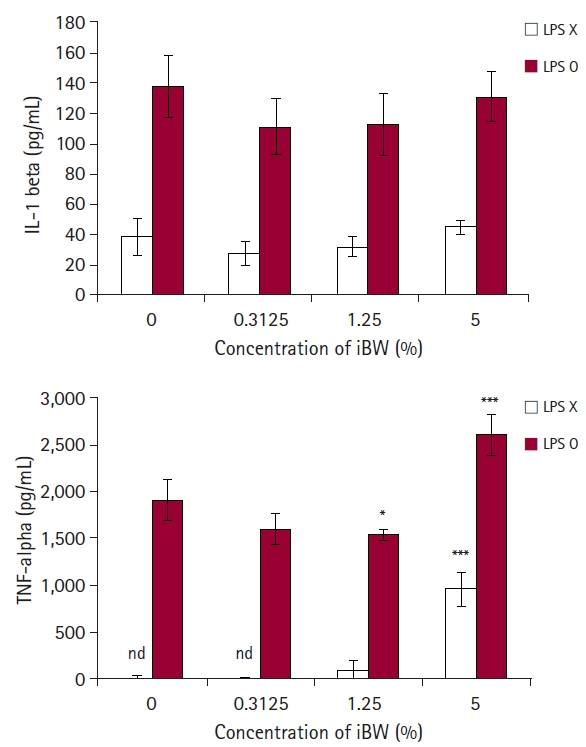
Fig. 3.
Expression of immune-related surface markers on dendritic cells (DCs). DCs were culture in 6-well plates at a concentration of 2 × 105 cells/mL and treated with 5% (v/v) ionized biosilica water (iBW) and 0.1 μg/mL lipopolysaccharide (LPS) for 3 days. After treatment, DCs were stained as described in Materials and Methods. The DC region was gated based on forward and side scatters. Histogram numbers indicate the mean fluorescence intensity.
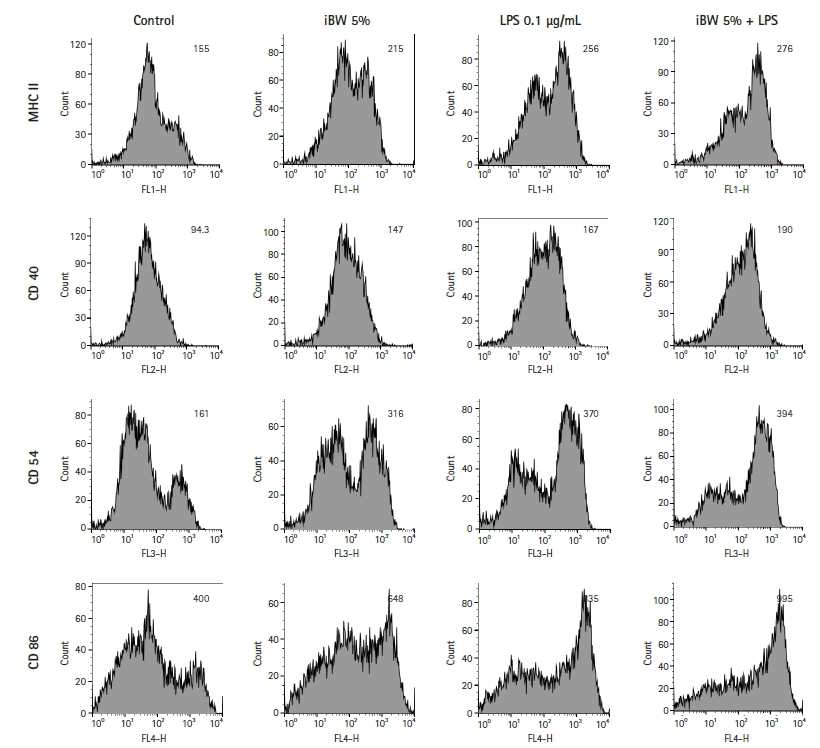
Fig. 4.
Effect of ionized biosilica water (iBW) on the antigen uptake capability of dendritic cells (DCs). DCs were cultured in 6-well plates at a concentration of 2 × 105 cells/mL and treated with 5% (v/v) iBW and 0.1 μg/mL lipopolysaccharide (LPS) for 3 days. After treatment, DCs were stained as described in Materials and Methods. The negative control was treated at 4℃, others were treated at 37℃ for 60 minutes. The DC region was gated based on forward and side scatters. Histogram numbers indicate the mean fluorescence intensity. FITC, fluorescein isothiocyanate.
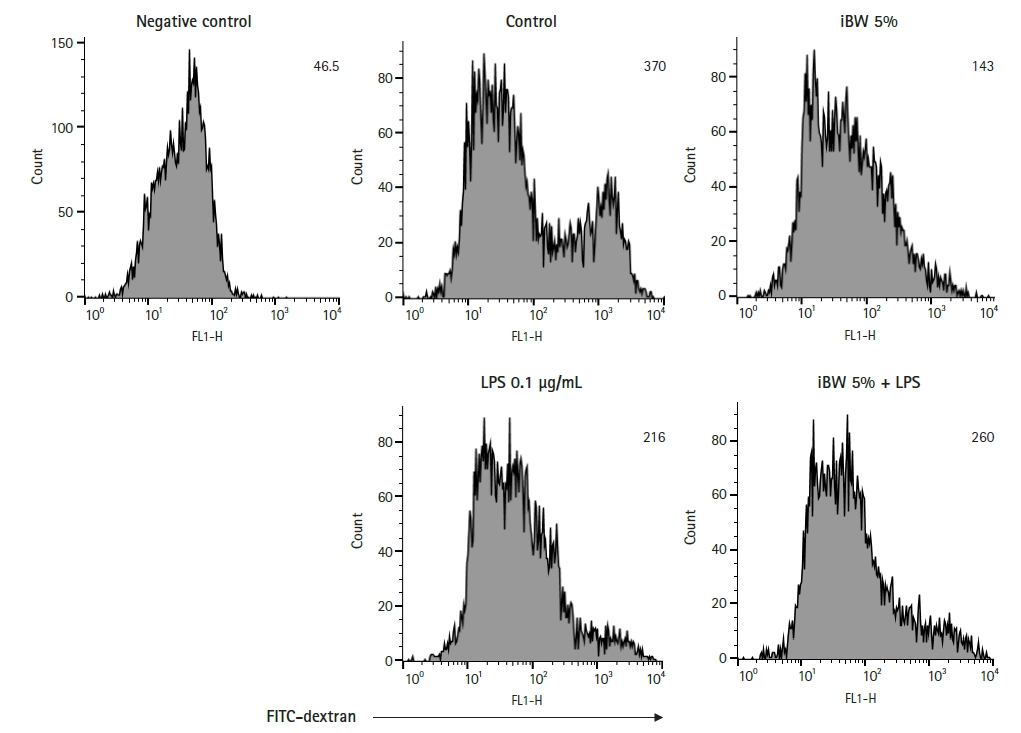
Fig. 5.
Effect of ionized biosilica water (iBW) on the antigen-presenting capability of dendritic cells (DCs). DCs were treated with 5% (v/v) iBW and 0.1 μg/mL lipopolysaccharide (LPS) for 2 days. The treated DCs were incubated with 50 μg/mL mitomycin C for 30 minutes before the co-culture step. Allogeneic spleen cells and DCs were co-cultured in 96-well culture plates at a concentration of 2 × 106 cells/mL and 1 × 105 cells/mL, respectively. After 5 days, cell counting kit-8 assays were performed as described in Materials and Methods. Data are presented as mean ± standard deviation. **p < 0.01. OD, optical density; ns, not significant.

References
1. Maher S, Kumeria T, Aw MS, Losic D. Diatom silica for biomedical applications: recent progress and advances. Adv Healthc Mater 2018;7:e1800552.


2. Lee J, Lee HA, Shin M, Juang LJ, Kastrup CJ, Go GM, Lee H. Diatom frustule silica exhibits superhydrophilicity and superhemophilicity. ACS Nano 2020;14:4755-4766.


3. Uthappa UT, Brahmkhatri V, Sriram G, Jung HY, Yu J, Kurkuri N, Aminabhavi TM, Altalhi T, Neelgund GM, Kurkuri MD. Nature engineered diatom biosilica as drug delivery systems. J Control Release 2018;281:70-83.


4. Cicco SR, Vona D, Leone G, De Giglio E, Bonifacio MA, Cometa S, Fiore S, Palumbo F, Ragni R, Farinola GM. In vivo functionalization of diatom biosilica with sodium alendronate as osteoactive material. Mater Sci Eng C Mater Biol Appl 2019;104:109897.


6. Chen L, Liu J, Zhang Y, Zhang G, Kang Y, Chen A, Feng X, Shao L. The toxicity of silica nanoparticles to the immune system. Nanomedicine (Lond) 2018;13:1939-1962.


7. den Haan JM, Arens R, van Zelm MC. The activation of the adaptive immune system: cross-talk between antigen-presenting cells, T cells and B cells. Immunol Lett 2014;162:103-112.


9. Mellman I. Dendritic cells: master regulators of the immune response. Cancer Immunol Res 2013;1:145-149.


10. Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S. Antigen presentation and T cell stimulation by dendritic cells. Annu Rev Immunol 2002;20:621-667.


11. Han Y, Joo HG. Determination of the toxicity of enrofloxacin on mouse bone marrow cells. J Prev Vet Med 2019;43:141-145.

12. Jang YR, Yoon HR, Kim MH, Joo HG. Anti-inflammatory activity of doxorubicin on lipopolysaccharide-induced hyperactivation of spleen cells. J Prev Vet Med 2018;42:61-65.

13. Lee YJ, Go GM, Joo HG. Immunomodulatory activity of biosilica water on mouse dendritic cells. J Prev Vet Med 2020;44:156-160.

14. Blanco P, Palucka AK, Pascual V, Banchereau J. Dendritic cells and cytokines in human inflammatory and autoimmune diseases. Cytokine Growth Factor Rev 2008;19:41-52.



- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,547 View
- 53 Download
- ORCID iDs
-
You-Jeong Lee

https://orcid.org/0000-0001-6847-2037Hong-Gu Joo

https://orcid.org/0000-0002-1505-8761 - Related articles


 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print