|
 |
| Korean J Vet Res > Volume 62(1); 2022 > Article |
|
Abstract
Disulfiram (DSF) is a marketed drug to treat patients with alcohol dependence by inhibiting aldehyde dehydrogenase. Over the last few decades, DSF has been shown to have anticancer effects through different mechanisms. Moreover, this effect can be elevated when used with copper (Cu). Subsequent studies have been conducted on various cancers, but few on lymphoma. This study investigated the anticancer effects of DSF on lymphoma and how this effect changed when treated with Cu. DSF synergistically decreased the metabolic activity of EL4 lymphoma cells when combined with Cu. At 1 ┬ĄM of DSF alone, the metabolic activity of EL4 cells decreased by 49% compared to the control, whereas it decreased by 87% with a DSF + CuCl2 treatment. Rhodamine 123 and 2',7'-dichlorofluorescein diacetate staining showed that DSF induced the reduction of the mitochondrial membrane potential and promoted the production of reactive oxygen species. In particular, the combined treatment of DSF + Cu induced cell death based on multiple assays, including annexin V-fluorescein isothiocyanate/propidium iodide staining. Overall, DSF has anticancer effects on lymphoma cells and exhibits synergistic effects when combined with Cu. This study provides some valuable information to broaden the use of DSF in clinics and basic research.
Disulfiram (DSF)ņØĆ 60ļģä ņØ┤ņāü ņĢīņĮöņś¼ņØśņĪ┤ņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśņŚłļŗż[1]. ņĢīņĮöņś¼ ņäŁņĘ© Ēøä, ņŚÉĒāäņś¼ņØĆ alcohol dehydrogenaseņŚÉ ņØśĒĢ┤ acetaldehydeļĪ£ ņĀäĒÖśļÉśĻ│Ā, aldehyde dehydrogenase (ALDH)ņŚÉ ņØśĒĢ┤ acetateļĪ£ ļīĆņé¼ļÉ£ļŗż. DSFļŖö ALDHņØś ĒÜ©ņåī ĒÖ£ņä▒ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ņ▓┤ļé┤ņŚÉņä£ acetaldehydeļź╝ ņČĢņĀüņŗ£ĒéżĻ│Ā, ņØ┤ļŖö ļæÉĒåĄ, ņ¢┤ņ¦Ćļ¤¼ņøĆ, ĒÖŹņĪ░ ļō▒ņØś ļČłņŠīĒĢ£ ņ”ØņāüņØä ņ£Āļ░£ĒĢśņŚ¼ ņĢīņĮöņś¼ ņäŁņĘ©ļź╝ ņĀ£ĒĢ£ņŗ£Ēé©ļŗż[2]. ĒĢ£ĒÄĖ ņĄ£ĻĘ╝ņŚÉļŖö DSFļź╝ ĒĢŁņĢöņĀ£ļĪ£ ĒÖ£ņÜ®ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŗżņ¢æĒĢ£ Ļ░üļÅäņŚÉņä£ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż[3].
DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝ļŖö ņ£Āļ░®ņĢö[4-6], ĒÅÉņĢö[7], ĻĄÉļ¬©ņäĖĒżņóģ[8], ļīĆņןņĢö[6] ļō▒ņŚÉņä£ ņŚ░ĻĄ¼ļÉśņŚłņ£╝ļ®░, reactive oxygen species (ROS) ņāØņä▒[4], proteasome ĒÖ£ņä▒ ņ¢ĄņĀ£[5], nuclear factor-kappa B [6]ļéś mitogen-activated protein kinase [9]ņÖĆ Ļ░ÖņØĆ ņŗĀĒśĖņĀäļŗ¼ ņ▓┤Ļ│äļź╝ ņĪ░ņĀłĒĢśļŖö ļō▒ņØś ļŗżņ¢æĒĢ£ ĒĢŁņĢö ĻĖ░ņĀäņØ┤ ņĢīļĀżņĪīļŗż. ĒŖ╣Ē׳ copper (Cu)ņÖĆ Ļ▓░ĒĢ®ļÉśņŚłņØä ļĢīļŖö DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝ļź╝ ņ”ØļīĆņŗ£ņ╝░ļŗż[6,8,9].
ļŗżņ¢æĒĢ£ ņĢöņŚÉņä£ DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝Ļ░Ć ņŚ░ĻĄ¼ļÉśĻ│Ā ņ׳ļŖö Ļ░ĆņÜ┤ļŹ░, ļ”╝ĒöäņóģņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņĢäņ¦ü ļČĆņĪ▒ĒĢśļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö, EL4 ņäĖĒżļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ T ļ”╝ĒöäņóģņŚÉ ļīĆĒĢ£ DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝ņÖĆ ņ×æņÜ®ĻĖ░ņĀäņØä ņĢīņĢäļ│┤ņĢśļŗż. ņØ┤ļź╝ ņ£äĒĢ┤, EL4 ņäĖĒżņŚÉ DSFļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢ£ Ēøä ņäĖĒżņØś ĒĢĄ ĒśĢĒā£ļź╝ Ļ┤Ćņ░░ĒĢśņśĆĻ│Ā, EL4 ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅä, ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ē ņĀäņ£ä(mitochondria membrane potential, MMP), ROS Ļ┤ĆļĀ©ņä▒ ļō▒ņØä ņĖĪņĀĢĒĢśņśĆļŗż. ļśÉĒĢ£, DSFĻ│╝ Cuļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼ĒĢśņŚ¼ CuĻ░Ć DSFņØś ĒÜ©ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źļÅä ņĢīņĢäļ│┤ņĢśļŗż.
EL4 ņäĖĒżņŻ╝(mouse lymphoma cell line)ļŖö ĒĢ£ĻĄŁņäĖĒżņŻ╝ņØĆĒ¢ē(Korean Cell Line Bank)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆļŗż. DSFļŖö Sigma-Aldrich (USA)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆņ£╝ļ®░, dimethyl sulfoxide (DMSO; Sigma-Aldrich)ņŚÉ ļģ╣ņØĖ Ēøä ņé¼ņÜ®ĒĢśņśĆļŗż. DMSO ņé¼ņÜ®ļåŹļÅäļŖö DSF 10 ┬ĄMņØś Ļ▓ĮņÜ░ 1% (v/v)ļź╝ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ļéśļ©Ėņ¦Ć ļ¬©ļōĀ DSF ņ▓śļ”¼ĻĄ░ņŚÉņä£ļŖö 0.1% (v/v) ņØ┤ĒĢśļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. Cu2+ ņ▓śļ”¼ļź╝ ņ£äĒĢ┤ CuCl2 (Sigma-Aldrich)ļź╝ ļ®ĖĻĘĀ ņ”ØļźśņłśņŚÉ ļģ╣ņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż.
EL4 ņäĖĒżļŖö 10% fetal bovine serum, 100 U/mL penicillin/streptomycin, 2 mM L-glutamineņØä ĒżĒĢ©ĒĢ£ RPMI 1640 ļ░░ņ¦ĆņŚÉņä£ 37Ōäā, 5% CO2ņØś ņĪ░Ļ▒┤ņ£╝ļĪ£ ļ░░ņ¢æĒĢśņśĆļŗż. 6-, 24- ļśÉļŖö 96-well culture plate (ThermoFisher Scientific, USA)ņŚÉ ļČäņŻ╝ĒĢ£ ļÆż, DSFĻ│╝ CuCl2ļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ ļ░░ņ¢æĒĢ£ Ēøä ļČäņäØĒĢśņśĆļŗż.
1 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢśĻ│Ā, CuCl2 1 ┬ĄMņØä ņČöĻ░ĆĒĢśņŚ¼, 96-well culture plateņŚÉņä£ 3ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æ Ēøä ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅä ņĖĪņĀĢņØä ņ£äĒĢ┤ 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide (MTT, Sigma-Aldrich) ņÜ®ņĢĪņØä 0.5 mg/mL ļåŹļÅäļĪ£ ļäŻĻ│Ā 4ņŗ£Ļ░ä ļÅÖņĢł 37Ōäā, 5% CO2ņŚÉņä£ ņ▓śļ”¼ĒĢśņśĆļŗż. ņäĖĒżņŚÉ ņØśĒĢ┤ ĒÖśņøÉļÉ£ formazan product (crystal violet)ņØä ņÜ®ĒĢ┤ņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ 10% sodium dodecyl sulfate ņÜ®ņĢĪņØä ļäŻņ¢┤ 2ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæņŗ£ņ╝░ļŗż. ĻĘĖ Ēøä microplate reader (ThermoFisher Scientific)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒØĪĻ┤æļÅä(570 nm)ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
ņäĖĒż ĒĢĄ ļ¬©ņ¢æņØś Ļ┤Ćņ░░ņØä ĒåĄĒĢ┤ ņäĖĒżņé¼ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ EL4 ņäĖĒżņØś ĒĢĄņØä ņŚ╝ņāēĒĢśņśĆļŗż. 2 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢśĻ│Ā CuCl2 1 ┬ĄMņØä ņČöĻ░ĆĒĢśņŚ¼, 24-well culture plateņŚÉņä£ 2ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ņäĖĒżņŚÉ Hoechst 33342 (Sigma-Aldrich) ņÜ®ņĢĪņØä 2.5 ╬╝g/mL ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ 37┬░CņŚÉņä£ 10ļČäĻ░ä ņŚ╝ņāēĒĢśņśĆļŗż. ĻĘĖ Ēøä ĒśĢĻ┤æĒśäļ»ĖĻ▓Į(ZOE Fluorescent Cell Imager; BIO-RAD, USA)ņØä ņØ┤ņÜ®ĒĢ┤ Ļ┤Ćņ░░ĒĢśņśĆļŗż.
ņäĖĒżņØś ņäĖĒżņé¼ ņĖĪņĀĢņØä ņ£äĒĢ┤ annexin V-fluorescein isothiocyanate (FITC)ņÖĆ propidium iodide (PI) ņÜ®ņĢĪņ£╝ļĪ£ ņŚ╝ņāēĒĢśņśĆļŗż. 2 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢśĻ│Ā CuCl2 1 ┬ĄMņØä ņČöĻ░ĆĒĢśņŚ¼, 24-well culture plateņŚÉņä£ 2ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æņØ┤ ļüØļéśļ®┤ annexin V binding buffer (ThermoFisher Scientific)ļĪ£ ņäĖņ▓Ö Ēøä annexin V-FITC (BD Bioscience, USA)ļź╝ 2 ┬Ąg/mL ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢ£ ļŗżņØī ņāüņś©, ņĢöņŗżņØś ņĪ░Ļ▒┤ņŚÉņä£ 10ļČäĻ░ä ļ░śņØæņŗ£ņ╝░ļŗż. PI ņÜ®ņĢĪņØĆ ļČäņäØ 5ļČä ņĀä 0.1 ┬Ąg/mL ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņśĆļŗż. LSRFortessa flow cytometerņÖĆ FlowJo software (BD Bioscience)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ£ĀņäĖĒżļČäņäØĒĢśņśĆļŗż.
1 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFĻ│╝ 3 mM N-acetyl-L-cysteine (NAC, Sigma-Aldrich)ņØä ņ▓śļ”¼ĒĢ£ Ēøä 96-well culture plateņŚÉņä£ 3ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. NACļŖö ROSņØś inhibitorļĪ£, ROSņØś Ļ┤ĆļĀ©ņä▒ ļČäņäØņØä ņ£äĒĢ┤ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ░░ņ¢æ Ēøä ļīĆņé¼ĒÖ£ņä▒ļÅä ņĖĪņĀĢļ░®ļ▓Ģņ£╝ļĪ£ MTT assayļź╝ ņØ┤ņÜ®ĒĢ┤ņä£ ļČäņäØĒĢśņśĆļŗż. CuCl2Ļ░Ć ROSņØś ņāØņä▒ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ 2',7'-dichlorofluorescin diacetate (DCFDA; Sigma-Adrich)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ£ĀņäĖĒżļČäņäØņØä ĒĢśņśĆļŗż. DCFDAļŖö ROSņŚÉ ņØśĒĢ┤ 2',7' -dichlorofluorescin (DCF)ņ£╝ļĪ£ ņé░ĒÖöļÉśņ¢┤ ņĖĪņĀĢļÉ£ļŗż. 2 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFĻ│╝ CuCl2ļź╝ ņ▓śļ”¼ĒĢśņŚ¼ 2ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æņØ┤ ļüØļéśļ®┤ ņØĖņé░ņÖäņČ®ņĢĪņ£╝ļĪ£ ņäĖņ▓ÖĒĢ£ Ēøä DCFDAļź╝ 10 ┬ĄM ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņśĆļŗż. 37ŌäāņŚÉņä£ 30ļČäĻ░ä ļ░śņØæņŗ£Ēé© Ēøä ņ£ĀņäĖĒżļČäņäØ ņŚ╝ņāēņÜ®ņĢĪņ£╝ļĪ£ ņäĖņ▓ÖĒĢ£ ļÆż ļČäņäØĒĢśņśĆļŗż. ņ£ĀņäĖĒżļČäņäØņØĆ LSRFortessa flow cytometerņÖĆ FlowJo softwareļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż.
2 ├Ś 105 cells/mL ļåŹļÅäņØś EL4 ņäĖĒżņŚÉ DSFļź╝ ļåŹļÅä ļ│äļĪ£ ņ▓śļ”¼ĒĢśĻ│Ā CuCl2 1 ┬ĄMņØä ņČöĻ░ĆĒĢśņŚ¼, 6-well culture plateņŚÉņä£ 2ņØ╝ ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. MMP ņĖĪņĀĢņØä ņ£äĒĢ┤ Rhodamine 123 (Sigma-Aldrich) ņÜ®ņĢĪņØä 0.1 ┬Ąg/mL ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢ£ Ēøä ņāüņś©, ņĢöņŗżņØś ņĪ░Ļ▒┤ņŚÉņä£ 30ļČä Ļ░ä ļ░śņØæņŗ£ņ╝░ļŗż. LSRFortessa flow cytometerņÖĆ FlowJo softwareļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ£ĀņäĖĒżļČäņäØĒĢśņśĆļŗż.
MTT assayņŚÉ ļīĆĒĢ£ Ļ▓░Ļ│╝ļŖö ĒÅēĻĘĀ ┬▒ Ēæ£ņżĆĒÄĖņ░©ļĪ£ ļéśĒāĆļāłņ£╝ļ®░, ordinary two-way ANOVA (GraphPad Prism; GraphPad Software, USA)ļź╝ ĒåĄĒĢ┤ ņ£ĀņØśņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż. nsļŖö ņ£ĀņØśņä▒ņØ┤ ņŚåņØīņØä, *, **, ***, ****ļŖö Ļ░üĻ░ü ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ p < 0.05, 0.01, 0.001, 0.0001ņ×äņØä ļéśĒāĆļéĖļŗż. #ņØĆ Ļ░ÖņØĆ DSF ļåŹļÅäņŚÉņä£ NAC ņ▓śļ”¼ ņ£Āļ¼┤ņŚÉ ļö░ļźĖ ņ▓śļ”¼ĻĄ░ Ļ░äņØś pĻ░ÆņØä ļéśĒāĆļé┤ļ®░, Ļ░£ņłśņŚÉ ļö░ļźĖ ņ£ĀņØśņä▒ ņĀĢļÅäļŖö ņ£äņÖĆ ļÅÖņØ╝ĒĢśļŗż.
DSF ļŗ©ļÅģ ļśÉļŖö DSF + CuCl2 (1 ╬╝M) ņ▓śļ”¼ĻĄ░ņŚÉņä£ EL4 ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅä ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ MTT assayļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 1). ļČäņäØ Ļ▓░Ļ│╝ DSFņØś ļ¬©ļōĀ ļåŹļÅä(0.01-10 ┬ĄM)ņŚÉņä£ DSF ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØ┤ ļé«ņØĆ ļīĆņé¼ĒÖ£ņä▒ļÅäļź╝ ļéśĒāĆļāłļŗż. ĒŖ╣Ē׳ DSF 1 ┬ĄMņŚÉņä£ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒ¢łņØä ļĢī DSF ļŗ©ļÅģņØĆ 49%, DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØĆ 87%ņØś ļīĆņé¼ĒÖ£ņä▒ļÅä Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. DSF ļŗ©ļÅģņ▓śļ”¼ĻĄ░ņØś Ļ▓ĮņÜ░ 0.01 ┬ĄMņŚÉņä£ ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć ņĢĮĻ░ä Ļ░ÉņåīĒĢśņśĆņ¦Ćļ¦ī ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśĻ│Ā, 10 ┬ĄMņŚÉņä£ļŖö ļīĆņé¼ĒÖ£ņä▒ņØ┤ Ļ▒░ņØś ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö DSFĻ░Ć 0.01 ┬ĄM ņØ┤ĒĢśņØś ļåŹļÅäņŚÉņä£ļŖö sub-cytotoxicĒĢśļŗżļŖö Ļ▓āņØä ļéśĒāĆļéĖļŗż. Half maximal inhibitory concentration (IC50)ņØä Ļ│äņé░ĒĢ£ Ļ▓░Ļ│╝ DSF ļŗ©ļÅģņØĆ 1.02 ┬ĄM, DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØĆ 0.25 ┬ĄMņ£╝ļĪ£, DSF ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ CuCl2ņÖĆ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢī ņäĖĒżļÅģņä▒ņØ┤ ņĢĮ 4ļ░░ ņ”ØĻ░ĆĒĢśņśĆņØīņØä ņĢī ņłś ņ׳ņŚłļŗż.
ņäĖĒżĒĢĄņØś ĒśĢĒā£ĒĢÖņĀü Ļ┤Ćņ░░ņØä ĒåĄĒĢ┤ ņäĖĒżņ×Éļ®Ėņé¼Ļ░Ć ņØ╝ņ¢┤ļéśļŖöņ¦Ć ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ Hoechst 33342Ļ│╝ PIļĪ£ ņäĖĒżļź╝ ņŚ╝ņāēĒĢśņśĆļŗż(Fig. 2A). ņé┤ņĢäņ׳ļŖö ņäĖĒż(Ēīīļ×Ćņāē)ņÖĆ ņŻĮņØĆ ņäĖĒż(ļČēņØĆņāēĻ│╝ ļČäĒÖŹņāē)ļź╝ ņāēĻ╣öļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. DSF ļŗ©ļÅģņ▓śļ”¼ĻĄ░ņØĆ ļīĆņĪ░ĻĄ░Ļ│╝ ņŻĮņØĆ ņäĖĒżņØś ņłśĻ░Ć ļ╣äņŖĘĒĢśņśĆĻ│Ā, CuCl2ņÖĆ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢīļŖö DSF 0.1 ┬ĄM + CuCl2ņŚÉņä£ ĒśäņĀĆĒĢśĻ▓ī ņŻĮņØĆ ņäĖĒżņØś ļ╣äņ£©ņØ┤ ļåÆņĢśļŗż(Fig. 2B). ļśÉĒĢ£ annexin V-FITC/PI ņŚ╝ņāē Ēøä ņ£ĀņäĖĒżļČäņäØņØä ņŗżņŗ£ĒĢśņŚ¼ ņäĖĒżņé¼ļź╝ ļŗ©Ļ│äļ│äļĪ£ ļČäņäØĒĢśņśĆļŗż(Fig. 2C). Necrosis (annexin V-/PI+), early apoptosis (annexin V+/PI-), late apoptosis (annexin V+/PI+)ļĪ£ ĻĄ¼ļČäĒĢśņśĆļŗż. DSF 0.1 ┬ĄMņŚÉ ļ╣äĒĢ┤ DSF 0.1 ┬ĄM + CuCl2ņŚÉņä£ early apoptosisņÖĆ late apoptosisĻ░Ć ļŹö ņ”ØĻ░ĆĒ¢łļŗż. ĒŖ╣Ē׳ DSF 0.1 ┬ĄM + CuCl2ņ▓śļ”¼ĻĄ░ņØĆ ņĀä ņŗżĒŚśĻĄ░ņŚÉņä£ viable cell (annexin V-/PI-)ņØś ļ╣äņ£©ņØ┤ Ļ░Ćņן ļé«ņĢśļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ DSFļŖö CuCl2ņŚÉ ņØśĒĢ┤ EL4 ņäĖĒżņØś ņäĖĒżņé¼ļź╝ ļŹöņÜ▒ ņ”Øņ¦äņŗ£Ēé¼ ņłś ņ׳ņØīņØä ņĢī ņłś ņ׳ņŚłļŗż.
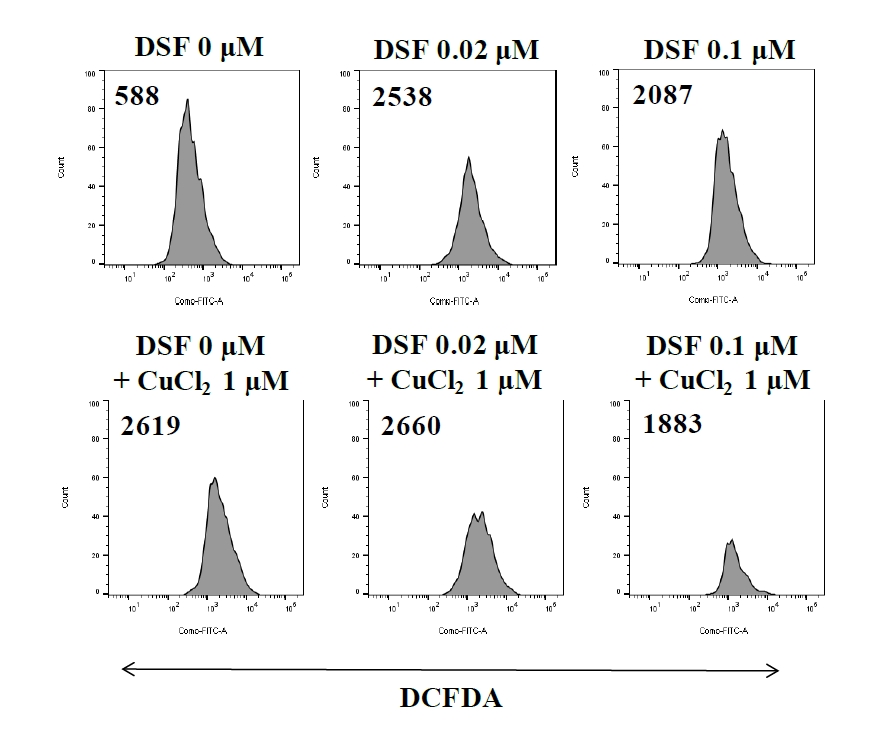
MMPļŖö ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäņØś ĻĖ░ļŖźņØä ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢ£ ĒĢäņłśņĪ░Ļ▒┤ņØ┤ļŗż. ņ£ĀņäĖĒżļČäņäØņŚÉņä£ forward scatter/side scatterņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ debrisļĪ£ ņČöņĀĢļÉśĻ▒░ļéś ņŻĮņØĆ ņäĖĒżļŖö ļ░░ņĀ£ĒĢ£ Ēøä ņé┤ņĢäņ׳ļŖö ņäĖĒżļōżņØä gatingĒĢśņŚ¼ MMP Ļ░ÆņØä ņĖĪņĀĢĒ¢łļŗż(Fig. 3). DSF 0.1 ╬╝M + CuCl2 (1 ╬╝M)ņŚÉņä£ fluorescence intensity ĒÅēĻĘĀĻ░ÆņØĆ Ļ░Ćņן ĒśäņĀĆĒ׳ ļé«ņĢśļŖöļŹ░, ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ 48% ļé«ņĢśļŗż. DSF 0.02 ╬╝M ļåŹļÅäņÖĆ 0.1 ╬╝M ļåŹļÅä ļ¬©ļæÉņŚÉņä£ CuCl2 (1 ╬╝M)ļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢīĻ░Ć DSF ļŗ©ļÅģņ▓śļ”¼ĻĄ░ļ│┤ļŗż ĒÅēĻĘĀĻ░ÆņØ┤ 40% ļé«ņĢśļŗż. DSFļź╝ CuCl2ņÖĆ ĒĢ©Ļ╗ś ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ EL4 ņäĖĒżņØś ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ĻĖ░ļŖźņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖĒ¢łļŗż.
DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝ņŚÉņä£ ROSĻ░Ć ņ¢┤ļ¢╗Ļ▓ī Ļ┤ĆļĀ©ļÉśļŖöņ¦Ć ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ROSņØś inhibitor ņżæ ĒĢśļéśņØĖ NACļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. DSFņØś ņ▓śļ”¼ ļåŹļÅäļ▓öņ£ä(0-10 ┬ĄM)ņŚÉņä£ DSF ļŗ©ļÅģņ▓śļ”¼ĻĄ░ļ│┤ļŗż DSFņÖĆ NACļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢī ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä, ROSĻ░Ć DSFļĪ£ ņ▓śļ”¼ļÉ£ EL4 ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅäļź╝ ļé«ņČöļŖö ņé¼ņŗżņØä ņĢī ņłś ņ׳ņŚłļŗż(Fig. 4A). ĒĢśņ¦Ćļ¦ī DSF + CuCl2 (1 ╬╝M) ņ▓śļ”¼ĻĄ░ņŚÉ NACļź╝ ļŹöĒĢ┤ ļ░śņØæņŗ£Ēéżļ®┤ DSFņØś ļ¬©ļōĀ ļåŹļÅäņŚÉņä£ ņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć ļ¦żņÜ░ ļ¢©ņ¢┤ņĪīļŗż(Fig. 4B). DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØś ROS ņāØņä▒ļ¤ēņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ DCFDAļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. DSF ļśÉļŖö CuCl2 ņ▓śļ”¼ĻĄ░ņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ROS ņāØņä▒ļ¤ēņØ┤ ņ”ØĻ░ĆĒ¢łļŗż(Fig. 5).
DSFļŖö 60ļģä ņØ┤ņāü ņĢīņĮöņś¼ņØśņĪ┤ņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż[1]. ņØ┤Ēøä DSFĻ░Ć ņĢīņĮöņś¼ņØśņĪ┤ņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśļŖö ĻĖ░ņĀäĻ│╝ļŖö ļŗżļźĖ ĻĖ░ņĀäņ£╝ļĪ£ ĒĢŁņĢöņ×æņÜ®ņØä ĒĢ£ļŗżļŖö ņŚ░ĻĄ¼ļÅä ņ¦äĒ¢ēļÉśņŚłļŗż[4-6]. ļśÉĒĢ£ ļīĆĻĘ£ļ¬©ļĪ£ 4,910ņóģņØś ņĢĮļ¼╝ ļ░Å Ēøäļ│┤ļ¼╝ņ¦łņØä ņŗżĒŚśĒĢ£ Ļ▓░Ļ│╝ DSFĻ░Ć ņĀäļ”ĮņäĀ ņĢöņäĖĒżņØś ņä▒ņןņØä ņ¢ĄņĀ£ĒĢśļŖö ļ¼╝ņ¦łļĪ£ ļ░ØĒśĆņ¦ĆĻĖ░ļÅä Ē¢łļŗż[10]. DSFļŖö ļ╣äĻĄÉņĀü Ļ░ĆĻ▓®ņØ┤ ņĀĆļĀ┤ĒĢśĻ│Ā, ņé¼ļ×īņŚÉņä£ ļČĆņ×æņÜ®Ļ│╝ ļÅģņä▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņČ®ļČäĒ׳ ņ¦äĒ¢ēļÉśņŚłĻĖ░ ļĢīļ¼ĖņŚÉ ĒĢŁņĢöņĀ£ļĪ£ņŹ© repurposing drugņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä ņ¦Ćļģöļŗż. ņØ┤ļ¤¼ĒĢ£ DSFņØś ĒĢŁņĢöĒÜ©Ļ│╝ļŖö CuņÖĆ ĒĢ©Ļ╗ś ņ▓śļ”¼ļÉÉņØä ļĢī ļŹöņÜ▒ ņ”ØĻ░ĢļÉśļ®░, ļŗżņ¢æĒĢ£ ņĢöņŚÉņä£ DSFņÖĆ CuņØś ĒĢŁņĢöĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĪīļŗż[8,9]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢģņä▒ T ļ”╝ĒöäņóģņŚÉņä£ ņØ┤ļź╝ ņŚ░ĻĄ¼ĒĢśņśĆļŗż.
DSFņØś ļ¬©ļōĀ ļåŹļÅä(0.01-10 ┬ĄM)ņŚÉņä£ DSF ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØ┤ ļŹö ļé«ņØĆ ļīĆņé¼ĒÖ£ņä▒ļÅäļź╝ ļ│┤ņśĆļŗż(Fig. 1). CuCl2ņØś ņ£Āļ¼┤ņŚÉ ļö░ļźĖ ņ░©ņØ┤ļŖö DSF 1 ┬ĄMņŚÉņä£ Ļ░Ćņן ņ╗Ėļŗż. DSF + CuCl2ņØś ņäĖĒżĒÖ£ņä▒ļÅä ņĀĆĒĢśņŚÉ ļīĆĒĢ£ ņ×æņÜ®ĻĖ░ņĀäņØä ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ ņäĖĒżņé¼ ņŚ¼ļČĆ, ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ĻĖ░ļŖź ļō▒ņØä ļČäņäØĒĢśņśĆļŗż. Hoechst 33342ļŖö Ļ▒┤Ļ░ĢĒĢ£ ņäĖĒżļ¦ēņØä Ļ┤ĆĒåĄĒĢśņŚ¼ DNAļź╝ Ēīīļ×Ćņāēņ£╝ļĪ£ ņŚ╝ņāēĒĢ£ļŗż[11]. ļ░śļ®┤ PIļŖö Ļ▒┤Ļ░ĢĒĢ£ ņäĖĒżļ¦ēņØä ĒåĄĻ│╝ĒĢśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņåÉņāüļÉ£ ņäĖĒżņØś ņŚ╝ņāēņ▓┤ļź╝ ļ╣©Ļ░Ģņāēņ£╝ļĪ£ ņŚ╝ņāēĒĢ£ļŗż. Hoechst 33342/PI ņŚ╝ņāēņØä ĒåĄĒĢ┤ DSFņÖĆ CuCl2ļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢī ņäĖĒżņé¼Ļ░Ć Ļ░Ćņן ņ”ØĻ░ĆĒ¢łļŗż(Fig. 2). ļśÉĒĢ£ Annexin V/PI ņŚ╝ņāēņØä ĒåĄĒĢ┤ ņäĖĒżņé¼ļź╝ ļŗ©Ļ│äņĀüņ£╝ļĪ£ ļéśļłäņ¢┤ ņłśņ╣śĒÖö Ē¢łņ£╝ļ®░, DSF 0.1 ┬ĄM + CuCl2ņŚÉņä£ ņé┤ņĢäņ׳ļŖö ņäĖĒż ņłśĻ░Ć Ļ░Ćņן ļé«ņØĆ ņé¼ņŗżņØä ĒÖĢņØĖĒ¢łļŗż.
ņäĖĒżņé¼ņØś ĻĖ░ņĀäņ£╝ļĪ£ MMPņÖĆ ROSņØś Ļ┤ĆļĀ©ņä▒ņØä ņĢīņĢäļ│┤ņĢśļŗż. Rhodamine 123ņØĆ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäņØś ņäĖĒżļ¦ēņØä ĒåĄĻ│╝ĒĢśļŖö ĒśĢĻ┤æņŚ╝ļŻīļĪ£, ņĀĢņāüņäĖĒżņŚÉņä£ļŖö ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļé┤ņŚÉ ņČĢņĀüļÉśņ¦Ćļ¦ī, ņåÉņāüļÉ£ MMPļź╝ Ļ░Ćņ¦ä ņäĖĒżņŚÉņä£ļŖö ņČĢņĀüļÉśņ¦Ć ņĢŖļŖöļŗż[12]. ROSļŖö ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäņØś ņĀäņ×ÉņĀäļŗ¼Ļ│äņŚÉņä£ ņĀĢņāüņĀüņ£╝ļĪ£ ņāØņä▒ļÉśļŖö Ļ│╝ņé░ĒÖöļ¼╝(peroxide) ļō▒ņØä ļ¦ÉĒĢśļ®░, ņ”ØĻ░ĆļÉ£ ROSļŖö ņäĖĒżņ×Éļ®Ėņé¼ ņĪ░ņĀł ļŗ©ļ░▒ņ¦ł(apoptosis regulatory protein)ņØś ļ░£ĒśäņŚÉ Ļ┤ĆņŚ¼ĒĢśņŚ¼ ņäĖĒżņé¼ļź╝ ņØ╝ņ£╝Ēé©ļŗż[13]. ļæÉ Ļ░Ćņ¦Ć ĻĖ░ņĀäņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ DSFĻ░Ć MMPņØś Ļ░ÉņåīņÖĆ ROSņØś ņāØņä▒ņØä ņ£ĀļÅäĒĢśņśĆĻ│Ā, CuCl2ļź╝ ĒĢ©Ļ╗ś ņ▓śļ”¼Ē¢łņØä ļĢī ņäĖĒżņé¼Ļ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä ņāüņŖ╣ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżļŖö ņé¼ņŗżņØä ņĢī ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ NACļź╝ ņØ┤ņÜ®ĒĢ£ ROS ņāØņä▒ļ¤ē ļČäņäØņŚÉņä£ DSF + CuCl2 ņ▓śļ”¼ĻĄ░ņØś ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć DSFņØś ļ¬©ļōĀ ļåŹļÅäņŚÉņä£ ļ¦żņÜ░ ļ¢©ņ¢┤ņĪīļŖöļŹ░, ņØ┤ļŖö CuCl2 + NACĻ░Ć ņäĖĒżļÅģņä▒ ņ×æņÜ®ņØä ļéśĒāĆļéĖ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż[14]. ļśÉĒĢ£ Ļ│©ņłśņóģņäĖĒżņŚÉņä£ DSF ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ DSFņÖĆ Cuļź╝ ĒĢ©Ļ╗ś ņé¼ņÜ®Ē¢łņØä ļĢī JNK ņŗĀĒśĖņĀäļŗ¼ņØ┤ ĒÖ£ņä▒ĒÖöļÉśņŚłļŗż[9]. Ē¢źĒøä EL4 ņäĖĒżņŚÉņä£ļÅä CuņØś ņāüņŖ╣ĒÜ©Ļ│╝ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņŗĀĒśĖņĀäļŗ¼ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ DSF + CuņØś ĒĢŁņĢöĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒ¢łņØīņŚÉļÅä, DSFĻ░Ć ĒĢŁņĢöņĀ£ļĪ£ Ļ░£ļ░£ļÉśļŖö ļŹ░ņŚÉļŖö ļ¬ć Ļ░Ćņ¦Ć ļŗ©ņĀÉņØ┤ ņ׳ļŗż. DSFļŖö ĒśłņĢĪ(pH 7.4) ļé┤ņŚÉņä£ ļ░śĻ░ÉĻĖ░Ļ░Ć 1-1.5ļČäņ£╝ļĪ£ ļ¦żņÜ░ ņ¦¦ņĢä[15], ĒśłņĢĪņŚÉņä£ ļīĆņé¼ļÉśļŖö Ļ│╝ņĀĢņŚÉņä£ ĒĢŁņĢöļŖźļĀźņØ┤ ļ¢©ņ¢┤ņ¦ł ņłś ņ׳ļŗż. ļŗżņ¢æĒĢ£ ņĢöņŚÉņä£ ĒĢŁņĢöņĀ£Ļ░Ć Ēæ£ņĀüņןĻĖ░ņŚÉ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ╣©Ēł¼ĒĢśĻ│Ā ņśżļל ļ©Ėļ¼╝Ļ▓ī ĒĢśĻĖ░ ņ£äĒĢ┤ nanoparticleļĪ£ packagingĒĢśņŚ¼ ņāØņ▓┤ņŚÉ ņĀüņÜ®ĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņŚ░ĻĄ¼ļÉśĻ│Ā ņ׳ļŗż[16,17]. ļö░ļØ╝ņä£ DSFļÅä ļŗ©ļÅģ ļśÉļŖö DSF + Cuļź╝ ņāłļĪ£ņÜ┤ drug delivery system (DDS)ņ£╝ļĪ£ ņĀæĻĘ╝ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż. ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ DSFņØś T ļ”╝ĒöäņóģņŚÉ Ļ┤ĆĒĢ£ ĒĢŁņĢöĒÜ©Ļ│╝Ļ░Ć in vitroņŚÉņä£ ĒÖĢņØĖļÉśņŚłņ£╝ļ»ĆļĪ£, Ē¢źĒøä DSFņØś in vivoņŚÉņä£ ĒĢŁņĢöĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņÖĆ ļ”╝ĒöäņóģņŚÉ DSF ļśÉļŖö DSF + Cuļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀäļŗ¼ĒĢĀ ņłś ņ׳ļŖö DDS ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
Fig.┬Ā1.
Effect of disulfiram (DSF) and CuCl2 on the metabolic activity of EL4 cells. EL4 cells (1 ├Ś 105 cells/mL) were cultured in 96-well culture plates with 0 to 10 ┬ĄM of DSF with or without 1 ┬ĄM of CuCl2. A MTT assay was performed 3 days after treatment. The optical density (OD) was measured at 570 nm using a microplate reader. The results are presented as the mean ┬▒ standard deviation, and the statistical significance was performed by ordinary two-way ANOVA. *, **, **** indicate p < 0.05, 0.01, and 0.0001 respectively compared to control EL4 (DSF 0 ┬ĄM). ns, not significant.
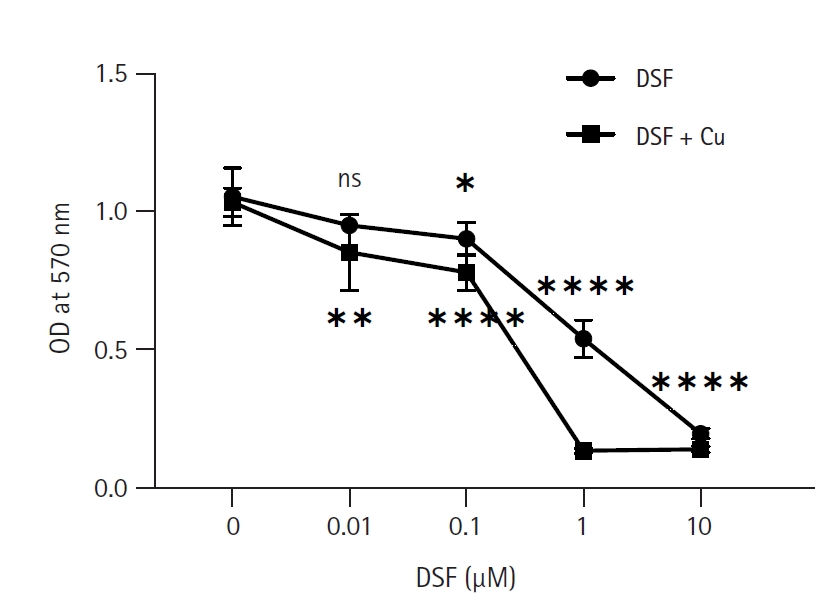
Fig.┬Ā2.
Disulfiram (DSF) induces the apoptosis and necrosis of EL4 cells and is enhanced when treated with CuCl2. EL4 (2 ├Ś 105 cells/mL) were cultured in 24-well culture plates with 0, 0.02, and 0.1 ┬ĄM of DSF with or without 1 ┬ĄM of CuCl2 for 2 days. (A) The cells were double-stained with Hoechst 33342 and propidium iodide (PI), and the images were captured using a fluorescence microscope. Scale bar: 50 ┬Ąm. (B) All cells were sorted by their color and converted to a percentage. (C) Annexin V-FITC/PI staining was performed. The quadrants of the dot plot indicate live cells (annexin V-/PI-), cells in early apoptosis (annexin V+/PI-), late apoptosis (annexin V+/PI+), and necrosis (annexin V-/PI+).

Fig.┬Ā3.
Disulfiram (DSF) treated with CuCl2 reduces the mitochondria membrane potential of EL4 cells. EL4 cells (2 ├Ś 105 cells/mL) were cultured in 6-well culture plates and treated as described in Fig. 2. The cells were stained with a Rhodamine123 solution and analyzed by flow cytometry on the FL1 channel. The number in histograms indicates the mean fluorescence intensity.

Fig.┬Ā4.
Involvement of reactive oxygen species generation in the effect of disulfiram (DSF). EL4 cells (1 ├Ś 105 cells/mL) were cultured in 96-well culture plates with 3 mM NAC and the following treatments: (A) 0 to 10 ┬ĄM of DSF. (B) 0 to 10 ┬ĄM of DSF with 1 ┬ĄM of CuCl2. A MTT assay was performed after 3 days of incubation. The optical density (OD) was measured at 570 nm using a microplate reader. The results are presented as the mean ┬▒ standard deviation, and the statistical significance was analyzed by ordinary two-way ANOVA. ## and #### indicate p < 0.01 and 0.0001, respectively, compared to the groups with and without NAC in each DSF concentration.
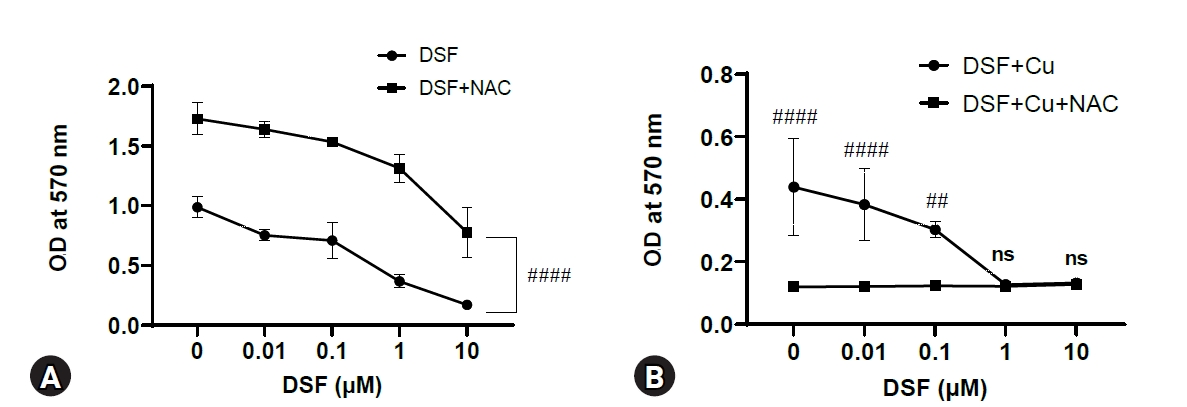
Fig.┬Ā5.
Disulfiram (DSF) and CuCl2 enhance ROS generation. EL4 cells (2 ├Ś 105 cells/mL) were cultured and treated as described in Fig. 2. The cells were then treated with10 ┬ĄM DCFDA for 30 minutes and analyzed by flow cytometry on the FL1 channel. The number in the histograms indicates mean fluorescence intensity.
References
1. Johansson B. A review of the pharmacokinetics and pharmacodynamics of disulfiram and its metabolites. Acta Psychiatr Scand Suppl 1992;369:15-26.


2. Suh JJ, Pettinati HM, Kampman KM, OŌĆÖBrien CP. The status of disulfiram: a half of a century later. J Clin Psychopharmacol 2006;26:290-302.

3. Skrott Z, Mistrik M, Andersen KK, Friis S, Majera D, Gursky J, Ozdian T, Bartkova J, Turi Z, Moudry P, Kraus M, Michalova M, Vaclavkova J, Dzubak P, Vrobel I, Pouckova P, Sedlacek J, Miklovicova A, Kutt A, Li J, Mattova J, Driessen C, Dou QP, Olsen J, Hajduch M, Cvek B, Deshaies RJ, Bartek J. Alcohol-abuse drug disulfiram targets cancer via p97 segregase adaptor NPL4. Nature 2017;552:194-199.



4. Yang Z, Guo F, Albers AE, Sehouli J, Kaufmann AM. Disulfiram modulates ROS accumulation and overcomes synergistically cisplatin resistance in breast cancer cell lines. Biomed Pharmacother 2019;113:108727.


5. Chen D, Cui QC, Yang H, Dou QP. Disulfiram, a clinically used anti-alcoholism drug and copper-binding agent, induces apoptotic cell death in breast cancer cultures and xenografts via inhibition of the proteasome activity. Cancer Res 2006;66:10425-10433.


6. Guo X, Xu B, Pandey S, Goessl E, Brown J, Armesilla AL, Darling JL, Wang W. Disulfiram/copper complex inhibiting NFkappaB activity and potentiating cytotoxic effect of gemcitabine on colon and breast cancer cell lines. Cancer Lett 2010;290:104-113.


7. Butcher K, Kannappan V, Kilari RS, Morris MR, McConville C, Armesilla AL, Wang W. Investigation of the key chemical structures involved in the anticancer activity of disulfiram in A549 non-small cell lung cancer cell line. BMC Cancer 2018;18:753.



8. Lun X, Wells JC, Grinshtein N, King JC, Hao X, Dang NH, Wang X, Aman A, Uehling D, Datti A, Wrana JL, Easaw JC, Luchman A, Weiss S, Cairncross JG, Kaplan DR, Robbins SM, Senger DL. Disulfiram when combined with copper enhances the therapeutic effects of temozolomide for the treatment of glioblastoma. Clin Cancer Res 2016;22:3860-3875.


9. Xu Y, Zhou Q, Feng X, Dai Y, Jiang Y, Jiang W, Liu X, Xing X, Wang Y, Ni Y, Zheng C. Disulfiram/copper markedly induced myeloma cell apoptosis through activation of JNK and intrinsic and extrinsic apoptosis pathways. Biomed Pharmacother 2020;126:110048.


10. Iljin K, Ketola K, Vainio P, Halonen P, Kohonen P, Fey V, Grafstr├Čm RC, Per├żl├ż M, Kallioniemi O. High-throughput cell-based screening of 4910 known drugs and drug-like small molecules identifies disulfiram as an inhibitor of prostate cancer cell growth. Clin Cancer Res 2009;15:6070-6078.


11. Crowley LC, Marfell BJ, Waterhouse NJ. Analyzing cell death by nuclear staining with Hoechst 33342. Cold Spring Harb Protoc 2016;2016.

12. Huang M, Camara AK, Stowe DF, Qi F, Beard DA. Mitochondrial inner membrane electrophysiology assessed by rhodamine-123 transport and fluorescence. Ann Biomed Eng 2007;35:1276-1285.



13. Trachootham D, Zhou Y, Zhang H, Demizu Y, Chen Z, Pelicano H, Chiao PJ, Achanta G, Arlinghaus RB, Liu J, Huang P. Selective killing of oncogenically transformed cells through a ROS-mediated mechanism by beta-phenylethyl isothiocyanate. Cancer Cell 2006;10:241-252.


14. Zheng J, Lou JR, Zhang XX, Benbrook DM, Hanigan MH, Lind SE, Ding WQ. N-Acetylcysteine interacts with copper to generate hydrogen peroxide and selectively induce cancer cell death. Cancer Lett 2010;298:186-194.


15. Agarwal RP, Phillips M, McPherson RA, Hensley P. Serum albumin and the metabolism of disulfiram. Biochem Pharmacol 1986;35:3341-3347.


- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,336 View
- 50 Download
- ORCID iDs
-
Haebeen Jung

https://orcid.org/0000-0002-2840-2541Hong-Gu Joo

https://orcid.org/0000-0002-1505-8761 - Related articles


 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print