|
 |
| Korean J Vet Res > Volume 62(2); 2022 > Article |
|
Abstract
Acknowledgments
Fig.┬Ā1.

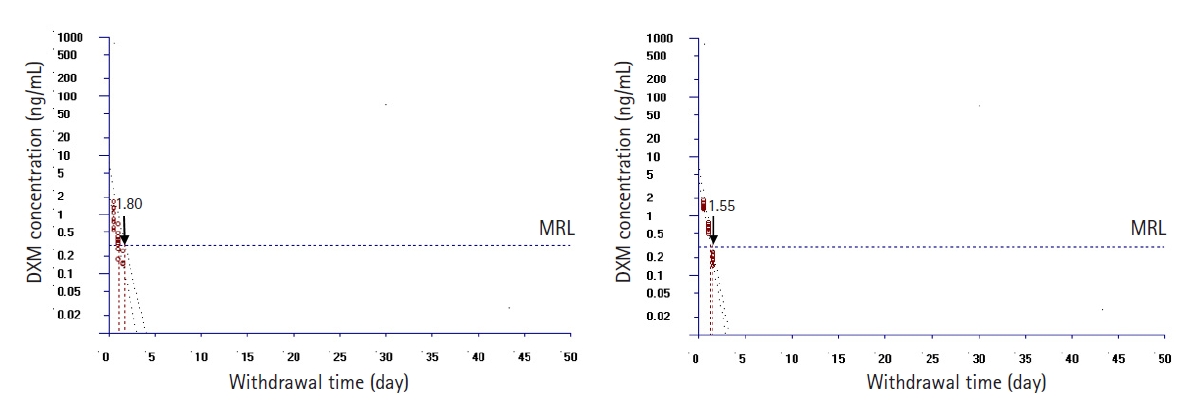
Fig.┬Ā3.
Table┬Ā1.
| Concentration (ng/mL) |
Recovery (%) |
Recovery (%) | CV (%) | ||
|---|---|---|---|---|---|
| No. 1 | No. 2 | No. 3 | |||
| 0.1 | 105.0 | 91.0 | 95.0 | 97.00┬▒7.21 | 7.43 |
| 1.0 | 101.0 | 109.0 | 102.0 | 104.00┬▒4.19 | 4.19 |
| 10.0 | 98.2 | 95.3 | 101.4 | 98.30┬▒3.10 | 3.10 |
Table┬Ā2.
| Group | No. |
Concentration (┬Ąg/kg) |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 h* | 12 hŌĆĀ | 24 h | 36 h | 48 h | 60 h | 72 h | 84 h | 96 h | 108 h | 120 h | ||
| DXM-1 | 1 | ND | 0.546 | 0.320 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | ND | 0.595 | 0.181 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | ND | 0.748 | 0.268 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | ND | 1.652 | 0.692 | 0.243 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | ND | 0.850 | 0.336 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | ND | 1.073 | 0.429 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 7 | ND | 1.310 | 0.377 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 8 | ND | 1.284 | 0.483 | 0.154 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | ND | 1.01┬▒0.39 | 0.39┬▒0.15 | 0.199 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| DXM-2 | 1 | ND | 1.440 | 0.500 | 0.246 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | ND | 1.640 | 0.574 | 0.220 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | ND | 1.380 | 0.548 | 0.191 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | ND | 1.610 | 0.533 | 0.142 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | ND | 1.820 | 0.717 | 0.185 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | ND | 1.650 | 0.774 | 0.150 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 7 | ND | 1.320 | 0.498 | 0.210 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 8 | ND | 1.460 | 0.648 | 0.175 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | ND | 1.54┬▒0.17 | 0.60┬▒0.10 | 0.19┬▒0.04 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
References
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,833 View
- 40 Download
- ORCID iDs
-
Kwangil Park

https://orcid.org/0000-0002-0199-8090Yeung Bae Jin

https://orcid.org/0000-0001-6783-7970Woohyun Kim

https://orcid.org/0000-0002-6874-6787Suk Kim

https://orcid.org/0000-0003-3474-9047Hu-Jang Lee

https://orcid.org/0000-0002-7552-6416 - Related articles



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print