|
 |
| Korean J Vet Res > Volume 60(1); 2020 > Article |
Abstract
Acknowledgments
Fig.┬Ā1.
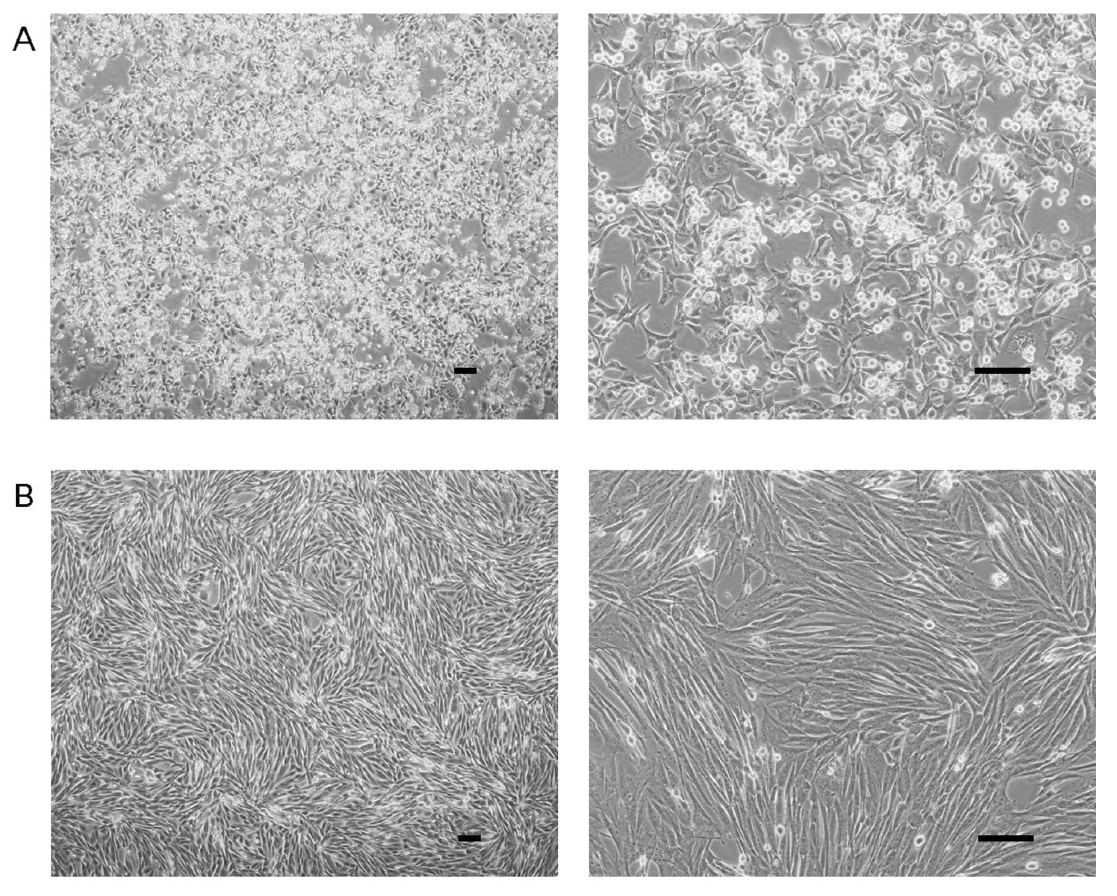
Fig.┬Ā2.
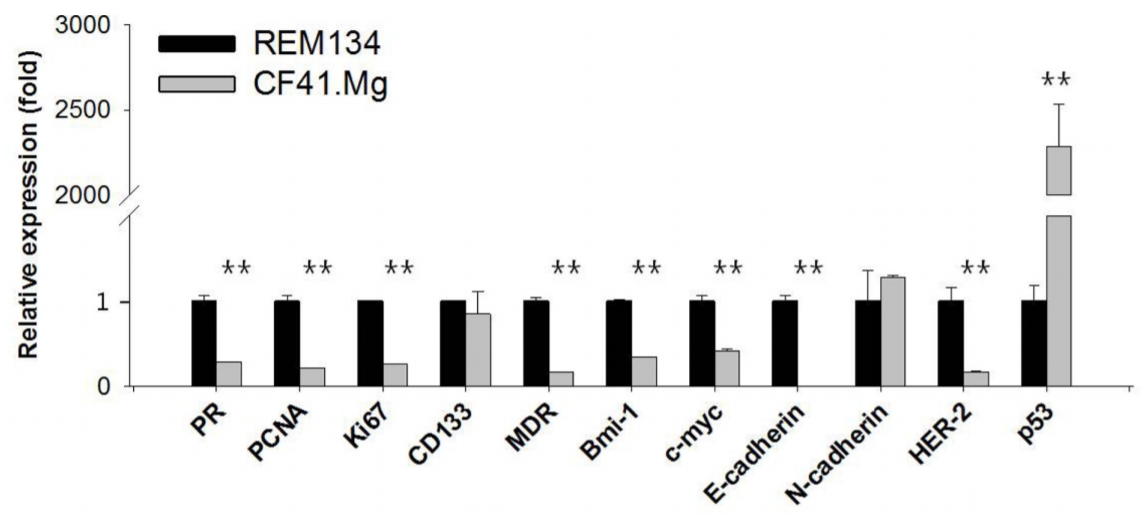
Fig.┬Ā3.
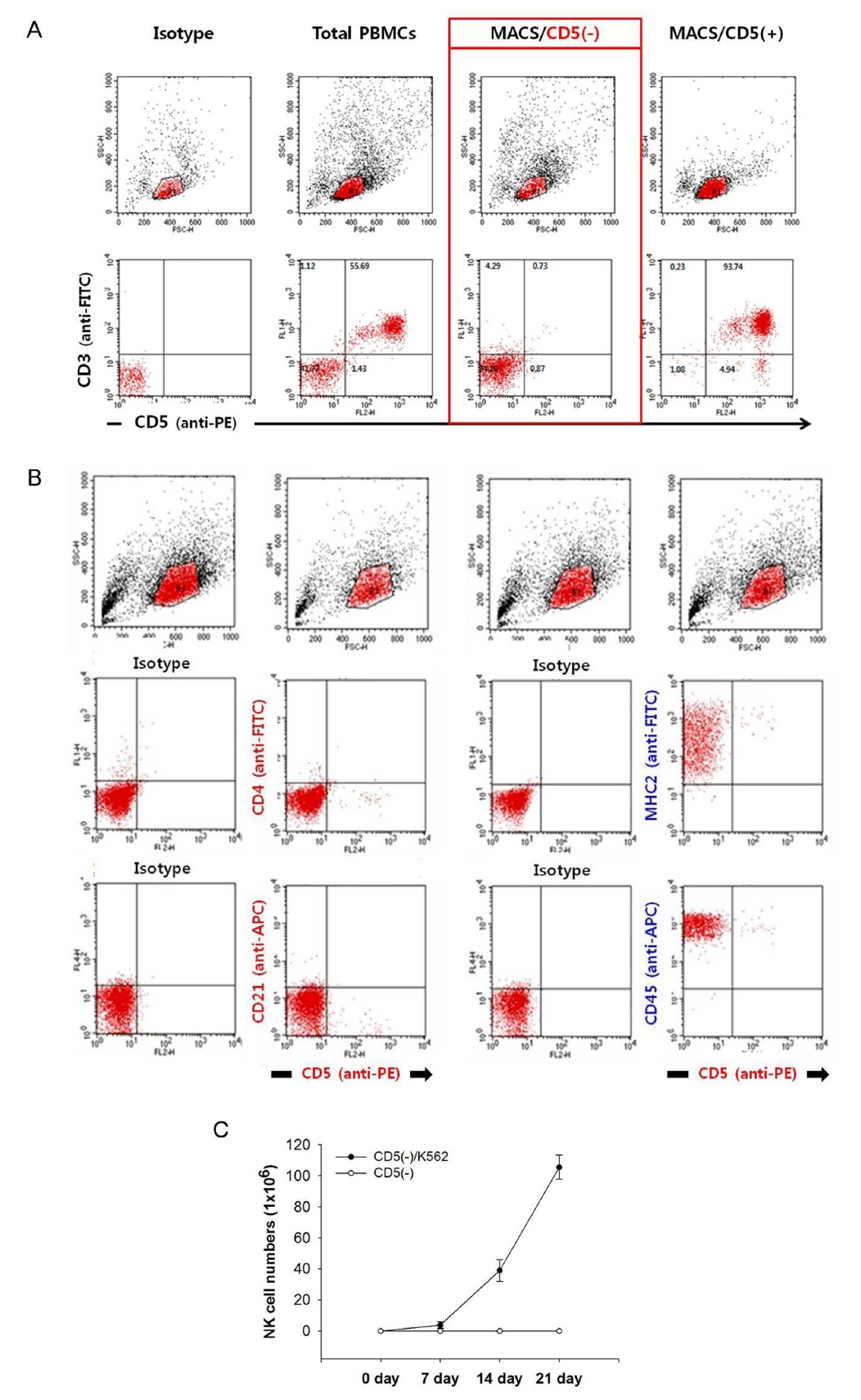
Fig.┬Ā4.

Fig.┬Ā5.

Fig.┬Ā6.
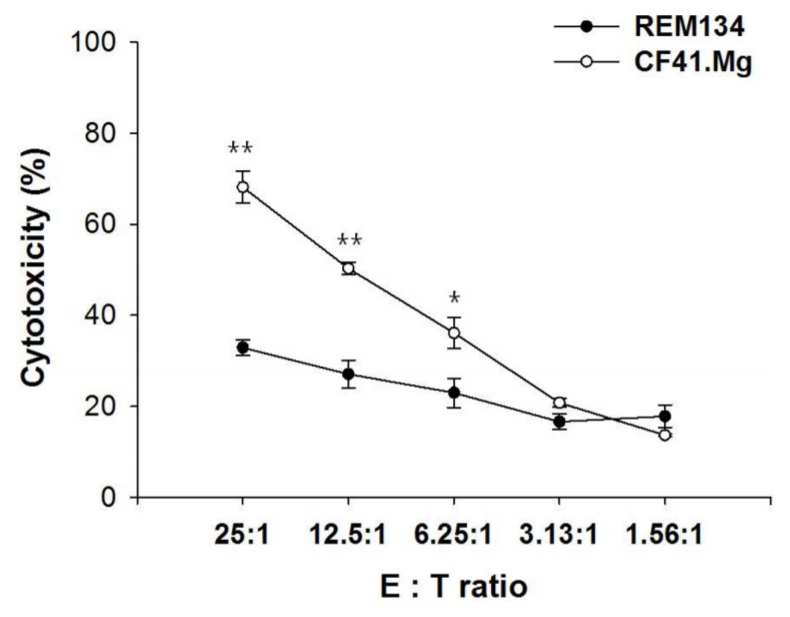
Table┬Ā1.
| Gene | Primer sequence (5ŌĆ▓-3ŌĆ▓) | Accession number |
|---|---|---|
| ╬▓-actin | F-GCT ACG TCG CCC TGG ACT TC | NM_001003349 |
| R-GCC CGT CGG GTA GTT CGT AG | ||
| PR | F-TAT TGC CGC ACA GTT ACC CA | NM_001003074 |
| R-TGG GCA CAC AGA AAC ACC TT | ||
| PCNA | F-TCC TGC GCA AAA GAT GGA GT | XM_534355.4 |
| R-GAG AGA GCG GAG TGG CTT TT | ||
| Ki67 | F-GGT CGT CTG AAA CCG GAG TT | XM_005637893.1 |
| R-GAG CTG GAG ATC CCT TAC GC | ||
| CD133 | F-AGC CCT GTT GAA CGT GAA CA | KJ654317 |
| R-GTT GTA GCC ACT GGA GGG AC | ||
| MDR | F-GAG GAC TTG AAT GAG AAT GTT CCT | [14] |
| R-CGG GTA AAG ATC CCT ATA ATC CTT | ||
| Bmi-1 | F-CAC TGT GAA TAA TGA CTT CTT GCA T | NM_001287063 |
| R-AAG TTT ACT TTC CTT TGA TCG GTT T | ||
| c-myc | F-AAT AGG AAC TAT GAC CTC GAC | [14] |
| R-AGC AGC TCG AAT TTC TTC CAG | ||
| E-cadherin | F-CTG ACC CTA CTG CTC CTC CT | NM_001287125 |
| R-ATG TCC GCC AGC TTC TTG AA | ||
| N-cadherin | F-TGT TTG TCC TCA CGG TTG CT | NM_0012871756 |
| R-AGT TGC CGT TGA CTG AGG AG | ||
| HER-2 | F-ATC AAC TGC ACC CAC TCC TG | NM_001003217 |
| R-GCG GCA ATG ATG GAT GTC AC | ||
| p53 | F-TTC CTC CCC GAT GGC TCT TA | CFU62133 |
| R-AGA TGC CAA ACC AGA CCT CG | ||
| NKp30 | F-TTG GCT CTG TCA CGT GGT AC | DQ003484 |
| R-CAG TGT CCC ATT CCC TGT CC | ||
| NKp44 | F-ATC GAG TGG CAG GGC AGA CA | XM_0846203 |
| R-TTC CTC CTT CAG ACC AAT CAT GGT | ||
| NKp46 | F-CCA GCA GAG CCC AAA ACA AC | NM_001284448 |
| R-CGG GAT GAA CGG AGA GAG TG | ||
| NKG2D | F-ACG AAG GCA AAA GAG AAA GCC | XM_849013 |
| R-TGA TGA TTA TGG CAC CGC AT | ||
| CD244 | F-GGA GGA GGC TGG GGT TTT AC | XM_022415323 |
| R-GCG CCA TCT ACT CTC ACT CC | ||
| Perforin | F-GAC AGA GCC CGT TGG AAG AA | FJ973622 |
| R-TTG GTG ATC CCC GAG TTG TG | ||
| Granzyme B | F-GGA ACA GGA GAA GAC CCA GC | XM_547752 |
| R-TTG GCC TTC CTC TCA AGC AG | ||
| TNF-╬▒ | F-GAG CCG ACG TGC CAA TG | Z70046 |
| R-CAA CCC ATC TGA CGG CAC TA |
References
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,815 View
- 68 Download
- ORCID iDs
-
Da-Un Jeong

https://orcid.org/0000-0002-2781-5491Jeong Su Byeon

https://orcid.org/0000-0003-4977-398XNa-Yeon Gu

https://orcid.org/0000-0001-6009-0093Moonhee Jung

https://orcid.org/0000-0001-5382-8459Eun Hee Kim

https://orcid.org/0000-0002-3331-5477Hyung-Seok Kim

https://orcid.org/0000-0002-8297-9747In-Soo Cho

https://orcid.org/0000-0002-2692-3191Jae-Young Song

https://orcid.org/0000-0001-6070-3785Bang-Hun Hyun

https://orcid.org/0000-0002-3429-3425Jienny Lee

https://orcid.org/0000-0001-5192-8800 - Related articles


 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print