|
 |
| Korean J Vet Res > Volume 61(3); 2021 > Article |
|
Abstract
Fenbendazole (FBZ) is a commonly used anthelmintics in veterinary medicine that has recently been found to have anticancer effects in humans. On the other hand, few studies have examined the anti-inflammatory effects of FBZ, and its mechanism is unknown. In this study, mouse bone marrow cells (BMs) were treated with lipopolysaccharide (LPS), a representative inflammation-inducing substance, to generate a situation similar to osteomyelitis in vitro. The effect of FBZ on inflammatory BMs was examined by measuring the metabolic activity, surface marker expression, cell nuclear morphology, and mitochondrial membrane potential (MMP) of BMs. FBZ decreased the metabolic activity and MMP of LPS-treated BMs. Annexin Ōģż-fluorescein isothiocyanate/propidium iodide staining and Hoechst 33342 staining showed that FBZ reduced the number of viable cells and induced the cell death of inflammatory BMs. In addition, FBZ reduced the proportion of granulocytes more than B lymphocytes in LPS-treated BMs. Overall, FBZ induces cell death by destabilizing the MMP of LPS-induced inflammatory BMs. In addition to anthelmintic and anticancer agent, FBZ can play a role as an anti-inflammatory agent.
Fenbendazole (FBZ)ņØĆ ņłśņØśņŚÉņä£ ņ£ĀņÜ®ĒĢśĻ▓ī ņō░ņØ┤ļŖö ĻĄ¼ņČ®ņĀ£ ņżæ ĒĢśļéśņØ┤ļŗż[1]. FBZņØĆ ņŗżĒŚśņÜ® ņäżņ╣śļźś, ļ░śļĀżļÅÖļ¼╝, ņé░ņŚģļÅÖļ¼╝ņŚÉņä£ ĒÜīņČ®, ņŗŁņØ┤ņ¦ĆņןņČ®, ĒÄĖņČ® ļō▒ ļé┤ļČĆ ĻĖ░ņāØņČ® Ļ░ÉņŚ╝ņØś ņśłļ░® ļ░Å ņ╣śļŻīņĀ£ļĪ£ ĒŚłĻ░Ć ļ░øņĢä ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[2,3]. ĻĄ¼ņČ® ņ×æņÜ®ĻĖ░ņĀäņ£╝ļĪ£ļŖö ĻĖ░ņāØņČ®ņØś ņäĖĒż ļČäņŚ┤ Ļ│╝ņĀĢ ņżæ ļ»ĖņäĖņåīĻ┤ĆņØś ĒśĢņä▒ņØä ļ░®ĒĢ┤ĒĢśņŚ¼ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[4,5].
ņĄ£ĻĘ╝ FBZņØ┤ ĒĢŁņĢöĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżļŖö ļ│┤Ļ│Ā[6]ņÖĆ ņØ╝ļČĆ ņ×äņāüņé¼ļĪĆļź╝ ņŗ£ņ×æņ£╝ļĪ£ ņ╗żļ«żļŗłĒŗ░, ņØĖĒä░ļäĘņØä ĒåĄĒĢ┤ FBZņØä ņ×äņØśļĪ£ ļ│ĄņÜ®ĒĢśļŖö ņé¼ļĪĆĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż. FBZņØĆ ņØĖĻ░ä ņĢöņäĖĒżņØś ļ»ĖņäĖņåīĻ┤ĆņŚÉ ņ╣£ĒÖöņä▒ņØä ļéśĒāĆļé┤Ļ│Ā micromolar ļåŹļÅäņŚÉņä£ ĒĢŁņĢöĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆņ£╝ļ®░, ņāłļĪ£ņÜ┤ ĒĢŁņĢöĻĖ░ņĀäņ£╝ļĪ£ GLUT transporterņÖĆ hexokinaseņØś ļ░£Ēśä ņ¢ĄņĀ£ļĪ£ glucose uptakeļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢśļŖö ņé¼ņŗżņØ┤ ņĢīļĀżņĪīļŗż[6].
Ļ│©ņłśļŖö ĒśłņĢĪņäĖĒżņÖĆ ļ®┤ņŚŁņäĖĒżĻ░Ć ņ£ĀļלĒĢśļŖö ĻĖ░Ļ┤Ćņ£╝ļĪ£ ļ®┤ņŚŁņ▓┤Ļ│äņŚÉņä£ ļ¦żņÜ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņÜ░ļ”¼ļŖö FBZņØ┤ ĒĢŁņĢöņĀ£ļĪ£ņä£ņØś Ļ░ĆļŖźņä▒ņØ┤ ļīĆļæÉļÉśĻ│Ā ņ׳ļŖö Ļ░ĆņÜ┤ļŹ░ Ļ│©ņłśņäĖĒżņŚÉ ļīĆĒĢ£ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ ļśÉĒĢ£ ņ׳ļŖöņ¦Ć ņØśļ¼ĖņØ┤ ļōżņŚłļŗż. ĒĢśņ¦Ćļ¦ī ņĢ×ņäĀ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĪ░ļźśņŚÉņä£ ņäĀņČ® Ļ░ÉņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢ£ Ļ│©ņłśņŚ╝ņŚÉ FBZņØä Ēł¼ņŚ¼ĒĢśņŚ¼ ņ╣śļŻīĒĢ£ ņé¼ļĪĆļ¦īņØ┤ ņĪ┤ņ×¼ĒĢśņśĆļŗż[7]. ņØ┤ņÖĆ Ļ░ÖņØ┤, FBZņØś Ļ│©ņłśņŚ╝ņŚÉ ļīĆĒĢ£ ĒÜ©Ļ│╝ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ¦ÄņØ┤ ļČĆņĪ▒ĒĢśļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö in vitroņŚÉņä£ Ļ│©ņłśņŚ╝Ļ│╝ ņ£Āņé¼ĒĢ£ ņāüĒÖ®ņØä ļ¦īļōżĻĖ░ ņ£äĒĢ┤ ļīĆĒæ£ņĀüņØĖ ņŚ╝ņ”Ø ņ£Āļ░£ļ¼╝ņ¦łņØĖ lipopolysaccharide (LPS)ļź╝ Ļ│©ņłśņäĖĒżņŚÉ ņ▓śļ”¼ĒĢśņŚ¼ FBZņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ ņ£Āļ¼┤ņÖĆ ņ×æņÜ®ĻĖ░ņĀäņØä ņĢīņĢäļ│┤ņĢśļŗż. ņØ┤ļź╝ ņ£äĒĢ┤ FBZņØä ļåŹļÅäļ│äļĪ£ ņ▓śļ”¼ĒĢ£ Ēøä Ļ│©ņłśņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅä, Ēæ£ļ®┤ ļ¦łņ╗ż ļ░£Ēśä, ņäĖĒżņØś ĒĢĄ ĒśĢĒā£, ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£ä(mitochondrial membrane potential) ļō▒ņØä ņĖĪņĀĢĒĢśņŚ¼ Ļ│©ņłśņäĖĒżņŚÉņä£ FBZņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ņŚ░ĻĄ¼ĒĢśņśĆļŗż.
ņŗżĒŚśļÅÖļ¼╝ņØĆ OrientBio (Korea)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņŚ¼ ņĀ£ņŻ╝ļīĆĒĢÖĻĄÉ ņŗżĒŚśļÅÖļ¼╝ņä╝Ēä░ņŚÉņä£ ņ£Āņ¦ĆĒĢśņśĆļŗż. ļÅÖļ¼╝ņŗżĒŚśņŚÉņä£ 8-12ņŻ╝ļĀ╣ ņé¼ņØ┤ņØś C57BL/6 ļ¦łņÜ░ņŖżĻ░Ć ņé¼ņÜ®ļÉśņŚłĻ│Ā, ņĀ£ņŻ╝ļīĆĒĢÖĻĄÉ ļÅÖļ¼╝ņŗżĒŚśņ£żļ”¼ņ£äņøÉĒÜīņØś ņŖ╣ņØĖņØä ļ░øņĢä ņŗ£Ē¢ēļÉśņŚłļŗż(ņŖ╣ņØĖļ▓łĒśĖ, 2018-0011). FBZĻ│╝ LPS (Escherichia coli O55)ļŖö Sigmaņé¼(USA)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņśĆņ£╝ļ®░, FBZņØĆ dimethyl sulfoxide, LPSļŖö ņØĖņé░ņÖäņČ®ņĢĪņŚÉ ļģ╣ņØĖ Ēøä ņé¼ņÜ®ĒĢśņśĆļŗż.
ļ│Ė ņŗżĒŚśņŗżņŚÉņä£ ĒÖĢļ”ĮļÉ£ ļ░®ļ▓Ģņ£╝ļĪ£ Ļ│©ņłśņäĖĒżļź╝ ļČäļ”¼ĒĢśņśĆļŗż[8]. CO2 gasļĪ£ ļ¦łņÜ░ņŖżļź╝ ņĢłļØĮņé¼ ņŗ£Ēé© ļÆż ļīĆĒć┤Ļ│©Ļ│╝ Ļ▓ĮĻ│©ņØä ņĀüņČ£ĒĢśņŚ¼ Ļ│©ņłśņĪ░ņ¦üņØä ņ▒äņĘ©ĒĢśņśĆļŗż. ņØ┤ ņĪ░ņ¦üņØä ammonium chloride-potassium lysis bufferļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ ņĀüĒśłĻĄ¼ļź╝ ņĀ£Ļ▒░ĒĢ£ Ēøä 70 ┬Ąm cell strainerņŚÉ Ļ▒Ėļ¤¼ single cellņØä ĒÜŹļōØĒĢśņśĆļŗż. ņØ┤ļź╝ Ļ│äņłśĒĢśņŚ¼ 96- ļśÉļŖö 6-well culture platesņŚÉ ļ░░ņ¢æĒĢśņśĆļŗż. FBZĻ│╝ LPSļź╝ ņ▓śļ”¼ĒĢ£ Ēøä 37Ōäā, 5% CO2ņØś ņĪ░Ļ▒┤ņŚÉņä£ ļ░░ņ¢æĒĢśņśĆĻ│Ā ļČäņäØņŚÉ ņØ┤ņÜ®ĒĢśņśĆļŗż.
Ļ│©ņłśņäĖĒżļź╝ 1 ├Ś 106 cells/mLņØś ļåŹļÅäļĪ£ 96-well culture plateņŚÉ ļäŻņØĆ Ēøä FBZĻ│╝ LPS (1 ┬Ąg/mL)ļź╝ ļåŹļÅäļ│äļĪ£ ņ▓śļ”¼ĒĢ£ Ēøä ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æņØ┤ ļüØļé£ Ēøä Ļ│©ņłśņäĖĒżņŚÉ 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide (MTT, Sigma) ņÜ®ņĢĪņØä 0.5 mg/mL ļåŹļÅäļĪ£ ļäŻĻ│Ā 4ņŗ£Ļ░ä ļÅÖņĢł ņ▓śļ”¼ĒĢśņśĆļŗż[9]. ņé┤ņĢäņ׳ļŖö ņäĖĒżņŚÉ ņØśĒĢ┤ ņāØĻĖ┤ crystal violetņØä ļģ╣ņØ┤ĻĖ░ ņ£äĒĢ┤ 10% sodium dodecyl sulfate ņÜ®ņĢĪņØä wellļŗ╣ 100 ╬╝Lņö® ļäŻņ¢┤ 2ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæņŗ£ņ╝░ļŗż. ĻĘĖ Ēøä microplate reader (Molecular Devicesņé¼, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒØĪĻ┤æļÅä(570 nm)ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
ļ¦łņÜ░ņŖż Ļ│©ņłśņäĖĒżļź╝ 6-well culture plateņŚÉ 1 ├Ś 106 cells/mLņØś ļåŹļÅäļĪ£ ļ░░ņ¢æĒĢśĻ│Ā FBZĻ│╝ LPSļź╝ ļåŹļÅäļ│äļĪ£ ņ▓śļ”¼ĒĢśņśĆļŗż. 3ņØ╝Ļ░ä ļ░░ņ¢æ Ēøä ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ ņĖĪņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ rhodamine 123 ņÜ®ņĢĪņØä 10 ╬╝g/mLņØś ļåŹļÅäļĪ£ ņĢöņŗżņĪ░Ļ▒┤ņŚÉņä£ 30ļČäĻ░ä ņŚ╝ņāēĒĢśņśĆļŗż. Ļ│©ņłśņäĖĒżņØś ņäĖĒżņé¼(cell death) ņĖĪņĀĢņØä ņ£äĒĢ┤ annexin Ōģż-fluorescein isothiocyanate (FITC)ņÖĆ propidium iodide (PI) ņÜ®ņĢĪņ£╝ļĪ£ ņŚ╝ņāēĒĢśņśĆļŗż[10]. ļśÉĒĢ£, Ļ│╝ļ”ĮĻĄ¼ņÖĆ Bļ”╝ĒöäĻĄ¼ņØś ļ╣äņ£©ņØä ņĖĪņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ allophycocyanin-labeled anti-Gr-1 ĒĢŁņ▓┤ņÖĆ biotin-labeled anti-B220 ĒĢŁņ▓┤, FITC-avidinņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņ£ĀņäĖĒż ļČäņäØņØĆ CytoFLEXņÖĆ CytExpert software (Beckman Coulter, USA)ļź╝ ņØ┤ņÜ®ĒĢ┤ ļČäņäØĒĢśņśĆļŗż.
Ļ│©ņłśņäĖĒżņØś ņäĖĒżņé¼ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ĒĢĄ ļ¬©ņ¢æņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ņäĖĒżņØś ĒĢĄņØä ņŚ╝ņāēĒĢśĻĖ░ ņ£äĒĢ┤ Hoechst 33342 ņÜ®ņĢĪņØä 2.5 ╬╝g/mL ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ 37┬░CņŚÉņä£ 10ļČäĻ░ä ņŚ╝ņāēĒĢśņśĆļŗż[11]. ņŚ╝ņāēļÉ£ ņäĖĒżļŖö ĒśĢĻ┤æĒśäļ»ĖĻ▓Į(ZOE Fluorescent Cell Imager; BIO-RAD, USA)ņØä ņØ┤ņÜ®ĒĢ┤ Ļ┤Ćņ░░ĒĢśņśĆĻ│Ā ņé¼ņ¦ä ņ┤¼ņśüņØä Ē¢łļŗż.
Ļ░ü ņŗżĒŚśņØĆ 2-3ĒÜī ļ░śļ│ĄĒĢśņŚ¼ ņŗ£Ē¢ēļÉśņŚłļŗż. Fig. 1ņØĆ ĒÅēĻĘĀ ┬▒ Ēæ£ņżĆĒÄĖņ░©ļĪ£ ļéśĒāĆļāłļŗż. One way analysis of variance ļČäņäØ ĒøäņŚÉ Turkey-Kramer multiple comparison test (GraphPad Prism; GraphPad Software, USA)ļĪ£ ņ£ĀņØśņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĒåĄĻ│äņ▓śļ”¼ Ēøä p-valueĻ░Ć 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż.
FBZ ļŗ©ļÅģĻ│╝ FBZ + LPS (1 ╬╝g/mL) ņ▓śļ”¼ĻĄ░ņŚÉņä£ Ļ│©ņłśņäĖĒżņØś ļīĆņé¼ĒÖ£ņä▒ļÅäļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ MTT assayļź╝ ņłśĒ¢ēĒĢśņśĆļŗż(Fig. 1). MTT assay Ļ▓░Ļ│╝ FBZ ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ FBZ + LPS ņ▓śļ”¼ĻĄ░ņØĆ ļ¬©ļōĀ ļåŹļÅä(0-1 ┬ĄM)ņŚÉņä£ ļ│┤ļŗż ļåÆņØĆ ļīĆņé¼ĒÖ£ņä▒ļÅäļź╝ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, FBZņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć Ļ░ÉņåīļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĒŖ╣Ē׳, FBZ ļŗ©ļÅģņØś 0.5-2 ┬ĄM ļåŹļÅäņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļīĆņé¼ĒÖ£ņä▒ļÅäĻ░Ć Ļ░ÉņåīĒĢśņśĆĻ│Ā, FBZ + LPS ņ▓śļ”¼ĻĄ░ņŚÉņä£ļŖö 1-2 ┬ĄM ļåŹļÅäņŚÉņä£ ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö FBZņØ┤ LPSņÖĆ Ļ░ÖņØĆ ņŚ╝ņ”Ø ļ¼╝ņ¦łņŚÉ ņØśĒĢ┤ ņ×ÉĻĘ╣ļÉ£ Ļ│©ņłśņäĖĒżņØś ĒÖ£ļÅÖņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ņØīņØä ļéśĒāĆļéĖļŗż.
FBZņØ┤ Ļ│©ņłśņäĖĒżņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ FBZĻ│╝ LPSļź╝ ņ▓śļ”¼ĒĢ£ Ļ│©ņłśņäĖĒżņØś ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņØ┤ļź╝ ņ£äĒĢ┤ rhodamine 123 ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢśņŚ¼ Ļ│©ņłśņäĖĒżļź╝ ņŚ╝ņāēĒĢ£ Ēøä ņ£ĀņäĖĒż ļČäņäØņØä ĒĢśņśĆļŗż(Fig. 2). LPSļŖö Ļ│©ņłśņäĖĒżņØś ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ ļåÆņØ┤ļŖö ļ░śļ®┤, FBZņØĆ LPSļĪ£ ņ”ØĻ░ĆļÉ£ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ Ēü¼Ļ▓ī Ļ░Éņåīņŗ£ņ╝░ļŗż. ĒŖ╣Ē׳, FBZ 0.25 ┬ĄM ļåŹļÅäņÖĆ FBZ 1 ┬ĄM ļåŹļÅäņØś fluorescence intensity ĒÅēĻĘĀĻ░ÆņØś ņ░©ņØ┤ļŖö 5,034ļĪ£, FBZ 0 ┬ĄM ļåŹļÅäņÖĆ FBZ 0.25 ┬ĄM ļåŹļÅäņØś ĒÅēĻĘĀĻ░ÆņØś ņ░©ņØ┤ņØĖ 1,083ļ│┤ļŗż Ēü¼ļŗż. ņØ┤ Ļ▓░Ļ│╝ļŖö 0.25-1 ┬ĄM ņé¼ņØ┤ ļåŹļÅäņØś FBZņØĆ LPSņŚÉ ņØśĒĢ┤ ņ×ÉĻĘ╣ļÉ£ Ļ│©ņłśņäĖĒżņØś ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ņØ┤ņżæļ¦ēņØś ĻĄ¼ņĪ░ļź╝ ļŹöņÜ▒ ļČłņĢłņĀĢĒĢśĻ▓ī ĒĢĀ ņłś ņ׳ņØīņØä ļéśĒāĆļéĖļŗż.
ņ£ĀņäĖĒż ļČäņäØņØĆ Ļ│©ņłśņäĖĒżņØś ņäĖĒżņé¼ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ annexin V-FITC/PI ņŚ╝ņāē Ēøä ņłśĒ¢ēļÉśņŚłļŗż(Fig. 3). FBZ ļŗ©ļÅģ ļśÉļŖö FBZ + LPS ņ▓śļ”¼ļÉ£ ņäĖĒżņØś viable cells (annexin V-/PI-)ņØś ļ╣äņ£©ņØ┤ ņ£Āņé¼ĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż. ņØ┤ Ļ░ÉņåīļŖö ĒŖ╣Ē׳ Fig. 2ņÖĆ Ļ░ÖņØ┤ FBZ 1 ┬ĄM ļåŹļÅäņŚÉņä£ ĒśäņĀĆĒĢśĻ▓ī Ļ░ÉņåīĒĢ©ņØä ļ│┤ņśĆļŗż. Viable cellsļŖö FBZ ļŗ©ļÅģņØ╝ ļĢī FBZ 0-0.25 ┬ĄMņØĆ 2.3%, FBZ 0.25-1 ┬ĄMņØĆ 13.8% Ļ░ÉņåīĒĢśņśĆļŗż. FBZ + LPS ņ▓śļ”¼ĻĄ░ņŚÉņä£ļÅä FBZ 0-0.25 ┬ĄMņØĆ 3.4%, FBZ 0.25-1 ┬ĄMņØĆ 9.3% Ļ░ÉņåīĒĢśņśĆļŗż. ņŻĮņØĆ ņäĖĒż ņżæ necrotic cells (annexin V-/PI+)ņØś ņłśļŖö FBZ 0-1 ┬ĄM ļåŹļÅäņŚÉņä£ 5%ņŚÉņä£ 6%ļĪ£ ņ”ØĻ░ĆĒĢ£ FBZ ļŗ©ļÅģņŚÉ ļ╣äĒĢ┤ FBZ + LPS ņ▓śļ”¼ĻĄ░ņŚÉņä£ ļŹöņÜ▒ ĒśäņĀĆĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņśĆļŗż. ĻĘĖļ¤¼ļéś early apoptosis cells (annexin V+/PI-)ņŚÉņä£ļŖö FBZ ļŗ©ļÅģņØĆ 6%ņŚÉņä£ 12%ļĪ£ ņ”ØĻ░ĆĒĢ£ ļ░śļ®┤, FBZ + LPS ņ▓śļ”¼ĻĄ░ņŚÉņä£ļŖö 10%ļĪ£ ņØ╝ņĀĢĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö FBZņØ┤ LPS ņ▓śļ”¼ ņŚ¼ļČĆņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ Ļ│©ņłśņäĖĒżņŚÉņä£ ņäĖĒżņé¼ļź╝ ņ£ĀļÅäĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆļŗż.
ļ¦łņÜ░ņŖż Ļ│©ņłśņäĖĒżņØś ņŻ╝ņÜö ĻĄ¼ņä▒ ņäĖĒż ņżæņŚÉļŖö Ļ│╝ļ”ĮĻĄ¼ņÖĆ Bļ”╝ĒöäĻĄ¼Ļ░Ć ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŗż. ļæÉ Ļ░Ćņ¦Ć ņäĖĒż ĻĄ¼ņä▒ņŚÉ FBZņØ┤ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤, FBZĻ│╝ LPSļĪ£ ņ▓śļ”¼ļÉ£ Ļ│©ņłśņäĖĒżļź╝ Gr-1 ļśÉļŖö B220 ĒŖ╣ņØ┤ņĀüņØĖ ĒĢŁņ▓┤ļĪ£ ņŚ╝ņāēĒĢ£ Ēøä ņ£ĀņäĖĒż ļČäņäØņØä ņŗżņŗ£ĒĢśņśĆļŗż(Fig. 4). Dot plotņØś Gr-1+ ĻĄ¼ņŚŁņØĆ ĒśĖņżæĻĄ¼ļź╝ ĒżĒĢ©ĒĢ£ Ļ│╝ļ”ĮĻĄ¼ņØ┤ļŗż. FBZ 0 ┬ĄM ļåŹļÅäņŚÉņä£ FBZ ļŗ©ļÅģņØĆ 27%, FBZ + LPS ņ▓śļ”¼ĻĄ░ņØĆ 25%ņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä LPSļŖö Ļ│╝ļ”ĮĻĄ¼ņØś ļ╣äņ£©ņØä Ēü¼Ļ▓ī ņ”ØĻ░Ćņŗ£Ēéżņ¦Ć ņĢŖņĢśļŗż. ļ░śļ®┤, FBZ 0-1 ┬ĄM ņé¼ņØ┤ņØś ļ│ĆĒÖöļź╝ ļ│┤ļ®┤ FBZ ļŗ©ļÅģņŚÉņä£ļŖö 27%ņŚÉņä£ 15%ļĪ£ Ļ░ÉņåīĒĢśņśĆĻ│Ā FBZ + LPS ņ▓śļ”¼ĻĄ░ņŚÉņä£ļŖö 25%ņŚÉņä£ 19%ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. Ļ│©ņłśņäĖĒżņŚÉ LPS ņ▓śļ”¼ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ Ļ│╝ļ”ĮĻĄ¼ņØś ļ╣äņ£©ņØĆ ĒśäņĀĆĒĢśĻ▓ī Ļ░Éņåīņŗ£ĒéżļŖö ņé¼ņŗżņØä ņĢī ņłś ņ׳ļŗż. Dot plotņØś B220+ ĻĄ¼ņŚŁņØĆ Bļ”╝ĒöäĻĄ¼ņØ┤ļŗż. Bļ”╝ĒöäĻĄ¼ņØś ļ╣äņ£©ņØĆ LPSņŚÉ ņØśĒĢ┤ ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖņĢśĻ│Ā, 28%ņŚÉņä£ 20%ļĪ£ ņśżĒ׳ļĀż Ļ░ÉņåīĒĢ£ ļ¬©ņŖĄņØä ļ│┤ņśĆļŗż. ļ░śļ®┤, LPS ņ£Āļ¼┤ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ FBZņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Bļ”╝ĒöäĻĄ¼ņØś ļ╣äņ£©ņØĆ ņ”ØĻ░ĆĒĢśņśĆļŗż.
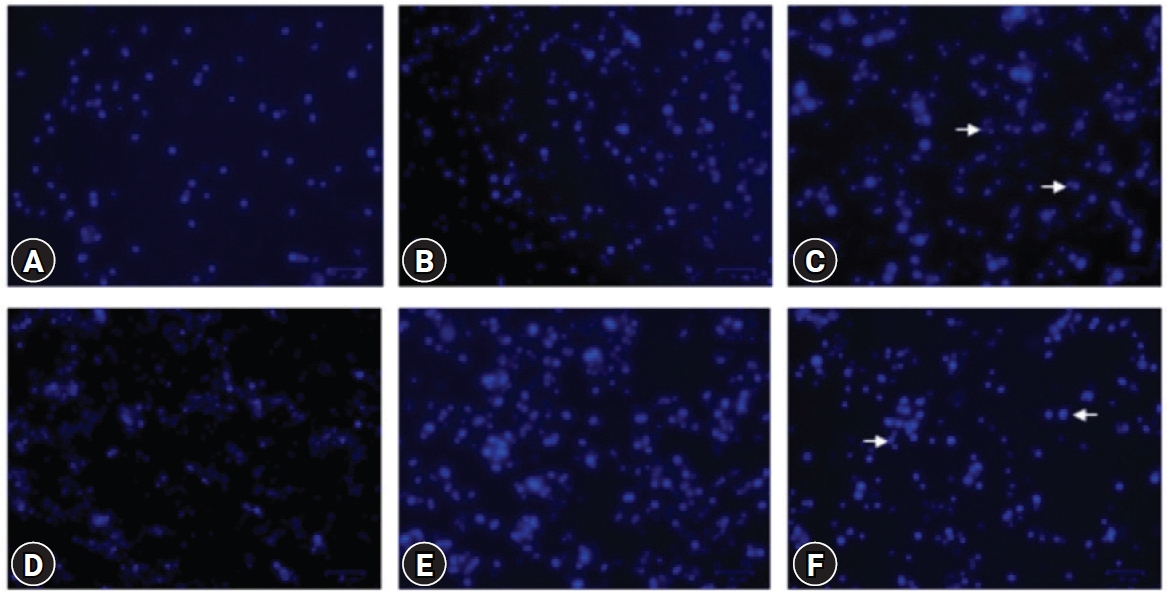
Ļ│©ņłśņäĖĒżļź╝ Hoechst 33342 ņÜ®ņĢĪņ£╝ļĪ£ ņŚ╝ņāēĒĢ£ Ēøä, ĒśĢĻ┤æĒśäļ»ĖĻ▓ĮņØä ņé¼ņÜ®ĒĢśņŚ¼ FBZņŚÉ ņØśĒĢ£ Ļ│©ņłśņäĖĒżņØś ĒĢĄ ĒśĢĒā£ ļ│ĆĒÖöļź╝ Ļ┤Ćņ░░ĒĢśņśĆļŗż(Fig. 5). FBZ ļŗ©ļÅģ ņ▓śļ”¼ĻĄ░ņŚÉņä£ļŖö 1 ┬ĄM ļåŹļÅäņŚÉņä£ ļłłņŚÉ ļØäĻ▓ī ļČäņĀłļÉ£ ĒĢĄņØä Ļ░Ćņ¦ä ņäĖĒżņØś ņłśĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż. LPS ņ▓śļ”¼ļĪ£ Ļ│©ņłśņäĖĒżņØś ņłśĻ░Ć ĒśäņĀĆĒĢśĻ▓ī ņ”ØĻ░ĆļÉśņŚłĻ│Ā FBZņØś 1 ┬ĄM ļåŹļÅäņŚÉņä£ ļČäņĀłļÉ£ ĒĢĄņØä Ļ░Ćņ¦ä ņäĖĒżņØś ņłśĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż. ĒĢĄņØ┤ ļČäņĀłļÉ£ ņäĖĒżĻ░Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØĆ ņäĖĒżņé¼ņØś ņ”ØĻ░Ćļź╝ ņØśļ»ĖĒĢśļ»ĆļĪ£ FBZ 1 ┬ĄMņØĆ LPS ņ£Āļ¼┤ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ Ļ│©ņłśņäĖĒżņØś ņäĖĒżņé¼ļź╝ ņ”ØĻ░Ćņŗ£ĒéżļŖö ņé¼ņŗżņØä ĒÖĢņØĖĒ¢łļŗż.
FBZņØĆ ņłśņØśņŚÉņä£ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņé¼ņÜ®ļÉśļŖö ĒĢŁĻĖ░ņāØņČ®ņĀ£ņĀ£ ņżæ ĒĢśļéśņØ┤ļ®░[1-3], ņĄ£ĻĘ╝ ņóģņ¢æņäĖĒżļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ĒĢŁņĢöĒÜ©Ļ│╝ļź╝ Ļ░¢ļŖöļŗżļŖö ņé¼ņŗżņØ┤ ļ░ØĒśĆņĪīļŗż[6]. ĒĢśņ¦Ćļ¦ī FBZņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ¦żņÜ░ ļ»ĖĒØĪĒĢśļ®░ ĻĘĖ ņ×æņÜ®ĻĖ░ņĀäļÅä ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö FBZņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ Ļ│©ņłśņäĖĒżņŚÉ ļīĆĒæ£ņĀüņØĖ ņŚ╝ņ”Øņä▒ ņ£ĀļÅäļ¼╝ņ¦ł ņżæ ĒĢśļéśņØĖ LPSļź╝ FBZĻ│╝ ĒĢ©Ļ╗ś ļ│ĄĒĢ® ņ▓śļ”¼ĒĢ£ Ēøä ļČäņäØĒĢśņśĆļŗż.
FBZņØ┤ ņäĖĒżĒÖ£ņä▒ļÅäņÖĆ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ Ļ░Éņåīņŗ£ņ╝£ Ļ│©ņłśņäĖĒżņØś ĒÖ£ņä▒ņØä ņ¢ĄņĀ£ĒĢśņśĆļŗż. ļśÉĒĢ£, annexin V-FITC/PI ņŚ╝ņāēĻ│╝ Hoechst 33342 ņŚ╝ņāēņØä ĒåĄĒĢ┤ FBZņØ┤ ņŚ╝ņ”Øņä▒ Ļ│©ņłśņäĖĒżņØś ņäĖĒżņé¼ļź╝ ņ£ĀļÅäĒĢśļŖö ņé¼ņŗżņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö LPS ņ▓śļ”¼ļĪ£ ļ¦īļōżņ¢┤ņ¦ä ņŚ╝ņ”Øņä▒ Ļ│©ņłśņäĖĒżņŚÉņä£ FBZņØ┤ ņäĖĒż ņłśņÖĆ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ĻĖ░ļŖźņØä ļ¬©ļæÉ Ļ░Éņåīņŗ£Ēé©ļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. Ļ│╝ļ”ĮĻĄ¼ņÖĆ Bļ”╝ĒöäĻĄ¼ņØś ĻĄ¼ņä▒ ļ╣äņ£© ļ│ĆĒÖöļź╝ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ FBZņØĆ LPSĻ░Ć ņ▓śļ”¼ļÉ£ Ļ│©ņłśņäĖĒżņŚÉņä£ Bļ”╝ĒöäĻĄ¼ļ│┤ļŗż Ļ│╝ļ”ĮĻĄ¼ņØś ļ╣äņ£©ņØä ļŹö Ļ░Éņåīņŗ£ņ╝░ļŗż.
FBZņØ┤ Ļ│╝ļ”ĮĻĄ¼ņØś ļ░£ĒśäņØä ņäĀĒāØņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢśļŖö ņĀĢĒÖĢĒĢ£ ĻĖ░ņĀäņØĆ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī, ņØ┤ļź╝ ņäżļ¬ģĒĢĀ ņłś ņ׳ļŖö ņäĀĒ¢ēņŚ░ĻĄ¼ļōżņØ┤ ņ׳ļŗż. ņ▓£ņŗØ ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ FBZņØ┤ ņĢīļĀłļź┤ĻĖ░ņä▒ ĻĖ░ļÅäņŚ╝ņ”ØĻ│╝ Th2 ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØś ņāØņé░ņØä Ļ░Éņåīņŗ£ņ╝░ļŗż[12]. FBZņØĆ ĻĖ░ņāØņČ® Ļ░ÉņŚ╝ņ”Ø ņ╣śļŻīņŚÉ ļŗżņ¢æĒĢśĻ▓ī ņØ┤ņÜ®ļÉ£ļŗż[13]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖ░ņāØņČ® Ļ░ÉņŚ╝ ņŗ£ ĒśĖņé░ĻĄ¼ļź╝ ĒżĒĢ©ĒĢ£ Ļ│╝ļ”ĮĻĄ¼Ļ░Ć ņ”ØĻ░ĆļÉśĻ│Ā[14], FBZņØ┤ ĻĖ░ņāØņČ® ņ╣śļŻīņŚÉ ņØ┤ņÜ®ļÉśļ»ĆļĪ£, FBZņØ┤ Ļ│╝ļ”ĮĻĄ¼ņØś ņł½ņ×É ļśÉļŖö ĻĖ░ļŖźņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØīņØä ņ£ĀņČöĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£, squirrel monkeyļź╝ ņØ┤ņÜ®ĒĢ£ ņĢ×ņäĀ ņŚ░ĻĄ¼ņŚÉņä£ ņ┤Ø ļ░▒ĒśłĻĄ¼, ĒśĖņżæĻĄ¼, ļŗ©ĒĢĄĻĄ¼ ļ░Å ĒśĖņé░ĻĄ¼ ņłś ļ╣äĻĄÉļŖö FBZņØä ņ▓śļ”¼ĒĢśņ¦Ć ņĢŖņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ FBZņØä ņ▓śļ”¼ĒĢ£ ĻĄ░ņŚÉņä£ ĒśäņĀĆĒ׳ Ļ░ÉņåīĒĢ£ ļ¬©ņŖĄņØä ļ│┤ņśĆļŗż[15]. ņØ┤ļź╝ ņóģĒĢ®ĒĢśļ®┤ FBZņØĆ Ļ│©ņłśņäĖĒż ņżæņŚÉņä£ļÅä Ļ│╝ļ”ĮĻĄ¼ļź╝ ĒŖ╣Ē׳ Ļ░Éņåīņŗ£Ēé©ļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. ļ░śļ®┤, FBZņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĀäņ▓┤ ņāØņĪ┤ ņäĖĒż ņłśņÖĆ Ļ│╝ļ”ĮĻĄ¼ļŖö ņżäņ¢┤ļō£ļŖöļŹ░, ļ”╝ĒöäĻĄ¼ņØś ņĀłļīĆĻ░ÆņØĆ Ēü¼Ļ▓ī ļ│ĆĒĢśņ¦Ć ņĢŖņĢä ņāüļīĆņĀüņØĖ ļ╣äņ£©ļĪ£ ļ”╝ĒöäĻĄ¼Ļ░Ć ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ņČöņĖĪĒĢĀ ņłś ņ׳ļŗż. ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĀłļīĆ ļ”╝ĒöäĻĄ¼ ņłśļŖö FBZ ņ╣śļŻīņŚÉ ņśüĒ¢źņØä Ļ▒░ņØś ļ░øņ¦Ć ņĢŖņĢśļŗż[15]. ĒĢśņ¦Ćļ¦ī FBZņØĆ ļ¦łņÜ░ņŖżņØś ļ®┤ņŚŁņ▓┤Ļ│äņŚÉ ņāüļŗ╣ĒĢ£ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä[16], Bļ”╝ĒöäĻĄ¼ņØś ĻĖ░ļŖźņØ┤ Ļ░ÉņåīļÉĀ Ļ░ĆļŖźņä▒ņØĆ ņ׳ļŗż.
ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņäżņ╣śļźśņŚÉņä£ FBZņŚÉ ņØśĒĢ£ Ļ│©ņłś ņ¢ĄņĀ£Ļ░Ć ļ░£ņāØĒĢśņ¦Ć ņĢŖņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[17]. ĒĢśņ¦Ćļ¦ī ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ│©ņłśņäĖĒżņŚÉ ļīĆĒĢ£ FBZņØś ņ¦üņĀæņĀüņØĖ ĒÜ©Ļ│╝ļź╝ ņĖĪņĀĢĒĢśņŚ¼ ņŗżĒŚśņĪ░Ļ▒┤ņØ┤ ļŗżļź┤ļŗż. ļśÉĒĢ£ LPSņŚÉ ņØśĒĢ┤ Ļ│╝ļÅäĒĢ£ ņŚ╝ņ”Ø ļ░śņØæņØ┤ ļ░£ņāØĒĢ£ Ļ│©ņłśņäĖĒżļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ FBZņØś ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ņłśĒ¢ēĒ¢łņ£╝ļ®░, FBZņØä ĒĢŁņŚ╝ņ”ØņĀ£ļĪ£ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒ¢łļŗż.
ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ņóģĒĢ®ĒĢśļ®┤, LPS ņ▓śļ”¼ļĪ£ ņØĖĒĢ┤ ņŚ╝ņ”Øņä▒ ņāüĒā£Ļ░Ć ļÉ£ Ļ│©ņłśņäĖĒżņŚÉņä£ FBZņØĆ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļ¦ēņĀäņ£äļź╝ ļČłņĢłņĀĢĒĢśĻ▓ī ļ¦īļōżņ¢┤ ņäĖĒżņé¼ļź╝ ņ£ĀļÅäņŗ£ņ╝£ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. Ē¢źĒøä ļ»ĖĒåĀņĮśļō£ļ”¼ņĢäņÖĆ FBZņØś Ļ┤ĆļĀ©ņä▒, ļŗżļźĖ ĒĢŁņŚ╝ņ”ØņĀ£ņÖĆņØś ņāüņŖ╣ ĒÜ©Ļ│╝, ļŗżņ¢æĒĢ£ ņŚ╝ņ”ØņØ┤ ņ£ĀļÅäļÉ£ ļÅÖļ¼╝ņ¦łĒÖś ļ¬©ļŹĖņŚÉņä£ņØś ņĢĮĒÜ© ņŗżĒŚśņØ┤ ņČöĻ░ĆņĀüņ£╝ļĪ£ ĒĢäņÜöĒĢśļŗż.
Fig.┬Ā1.
Fenbendazole (FBZ) decreases the metabolic activity of lipopolysaccharide (LPS)-treated and untreated bone marrow cells (BMs). BMs (1 ├Ś 106 cells/mL) were incubated in 96-well culture plates and treated with FBZ in the absence or presence of 1 ┬Ąg/mL LPS. The concentration range of FBZ was 0 to 2 ┬ĄM and treated by 2-fold dilution stepwise. MTT assay was performed at 3 days after the drug treatment. The data are presented as the mean ┬▒ standard deviation. ***, ### indicate p < 0.001 and **, ## indicate p < 0.01, compared to the BMs treated without LPS or LPS alone (FBZ 0 ┬ĄM), respectively. OD, optical density.
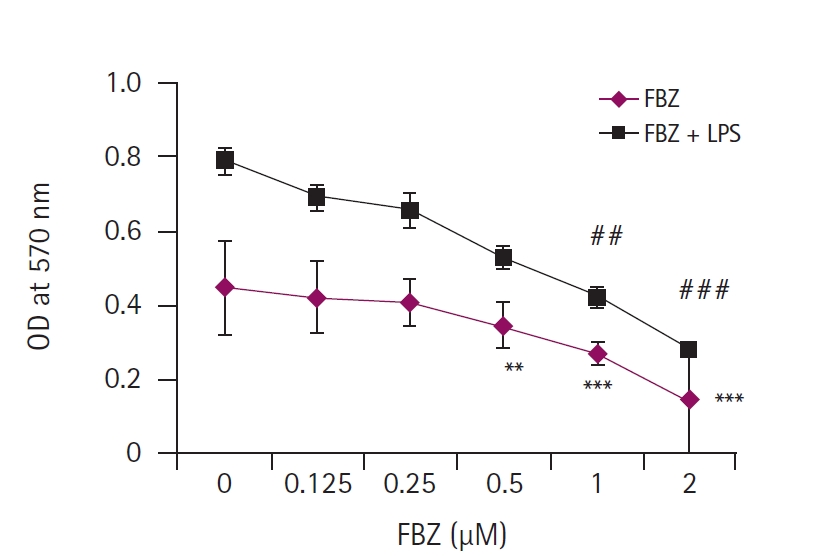
Fig.┬Ā2.
Fenbendazole (FBZ) reduces the mitochondrial membrane potential of both lipopolysaccharide (LPS)-treated and untreated bone marrow cells (BMs). Mouse BMs in 6-well culture plates were treated with or without 1 ┬Ąg/mL LPS for 2 days, followed by an FBZ treatment. The treated BMs were stained with Rhodamine 123 solution. The number in histograms indicates the mean fluorescence intensities. (A) FBZ 0 ┬ĄM, (B) FBZ 0.25 ┬ĄM, (C) FBZ 1 ┬ĄM, (D) FBZ 0 ┬ĄM + LPS 1 ┬Ąg/mL, (E) FBZ 0.25 ┬ĄM + LPS 1 ┬Ąg/mL, and (F) FBZ 1 ┬ĄM + LPS 1 ┬Ąg/mL.
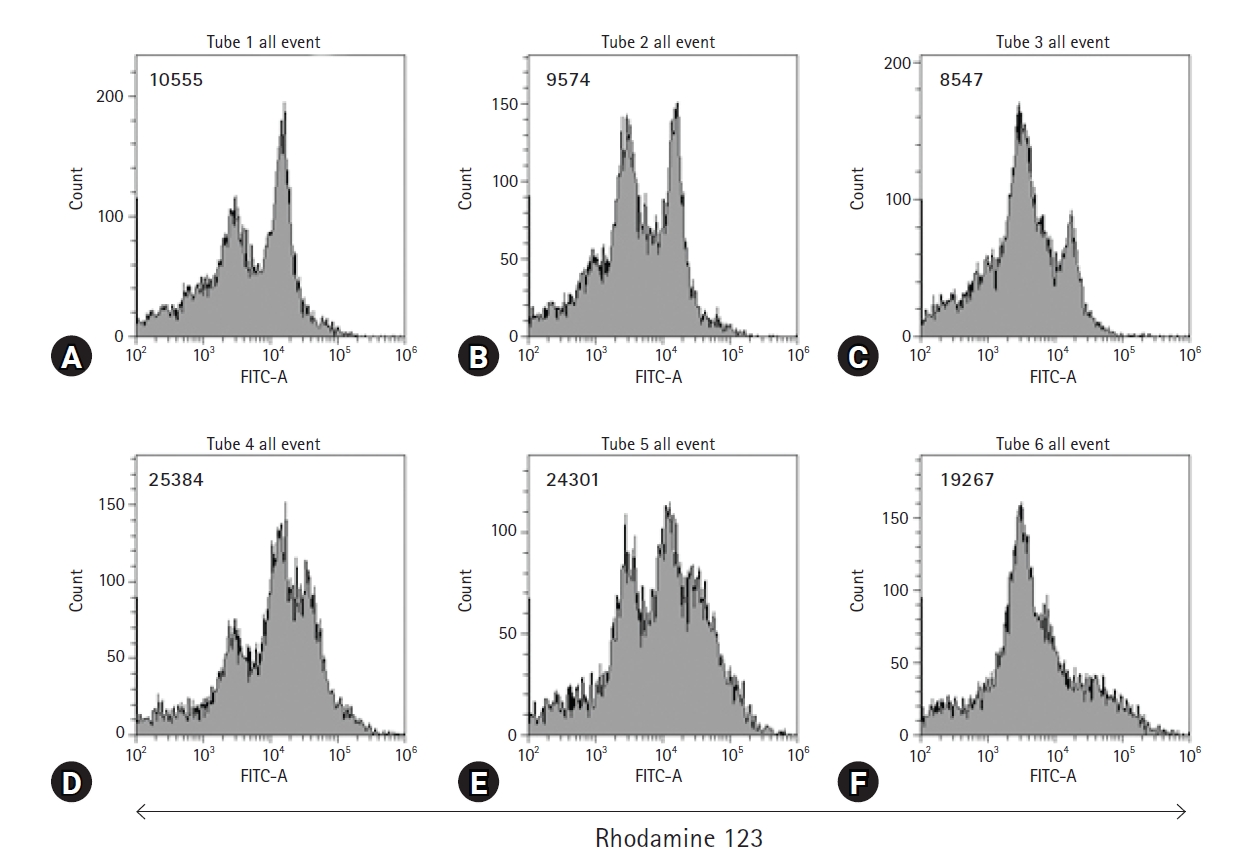
Fig.┬Ā3.
Fenbendazole (FBZ) induces the apoptosis and necrosis of lipopolysaccharide (LPS)-treated and untreated bone marrow cells (BMs). The cells were cultured in 6-well culture plates and treated with FBZ (0, 0.25, 1 ┬ĄM) and LPS (1 ┬Ąg/mL). Annexin V-FITC/PI staining was performed after 2 days of treatment. The cells in the quadrants indicate necrosis (upper left, UL), late apoptosis (upper right, UR), viable (lower left, LL), and early apoptosis (lower right, LR) cells, respectively. The number in quadrants indicates the percentage of cells. (A) FBZ 0 ┬ĄM, (B) FBZ 0.25 ┬ĄM, (C) FBZ 1 ┬ĄM, (D) FBZ 0 ┬ĄM + LPS 1 ┬Ąg/mL, (E) FBZ 0.25 ┬ĄM + LPS 1 ┬Ąg/mL, (F) FBZ 1 ┬ĄM + LPS 1 ┬Ąg/mL. PI, propidium iodide.
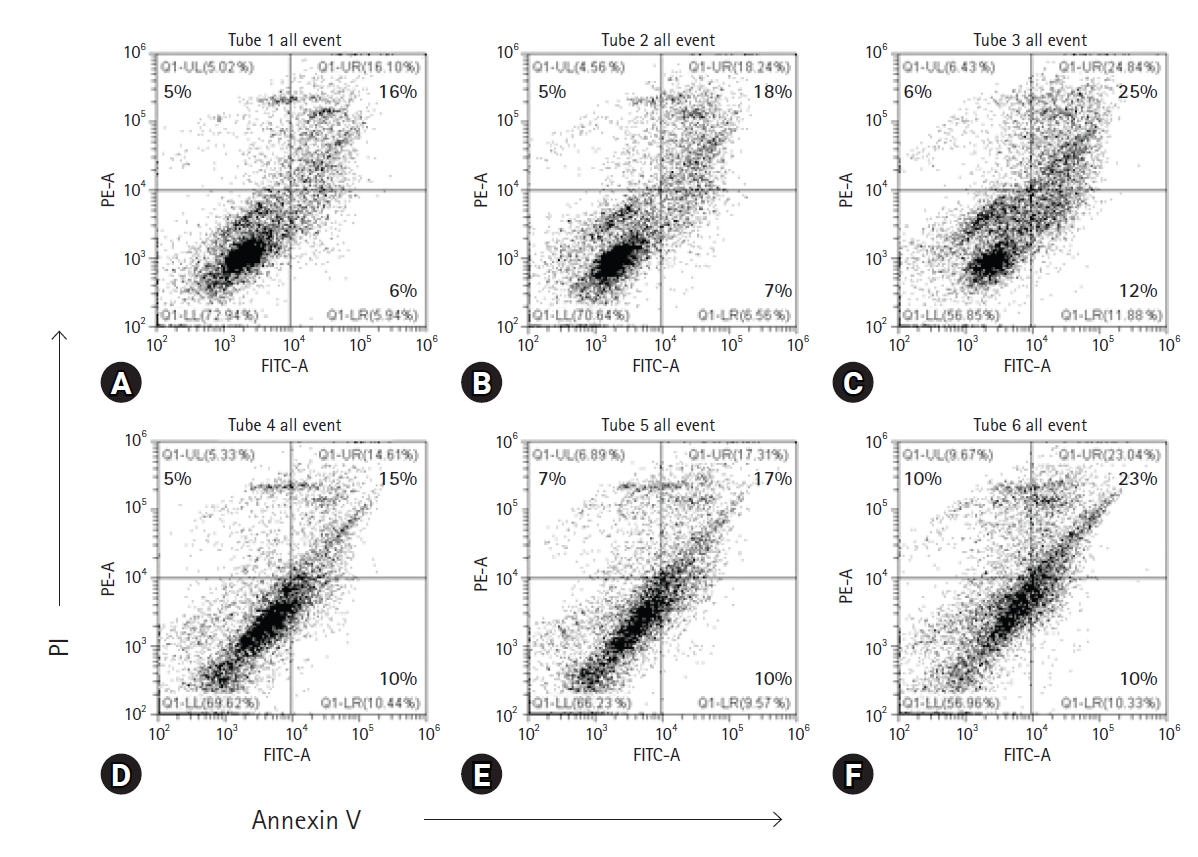
Fig.┬Ā4.
Fenbendazole (FBZ) significantly decreases granulocytes than B cells in bone marrow cells (BMs). BMs (1 ├Ś 106 cells/mL) were seeded in 6-well culture plates and treated with FBZ and lipopolysaccharide (LPS). The cells were stained with anti-B220 or Gr-1 specific antibody. The cells were analyzed using flow cytometry. The upper squares in dot plots indicate the population of Gr-1 positive cells, granulocytes. The lower squares in dot plots indicate the population of B220 positive cells, B cells. Irrespective of the presence of LPS, the proportion of granulocytes decreased, but that of B cells increase. (A) FBZ 0 ┬ĄM, (B) FBZ 0.25 ┬ĄM, (C) FBZ 1 ┬ĄM, (D) FBZ 0 ┬ĄM + LPS 1 ┬Ąg/mL, (E) FBZ 0.25 ┬ĄM + LPS 1 ┬Ąg/mL, and (F) FBZ 1 ┬ĄM + LPS 1 ┬Ąg/mL.
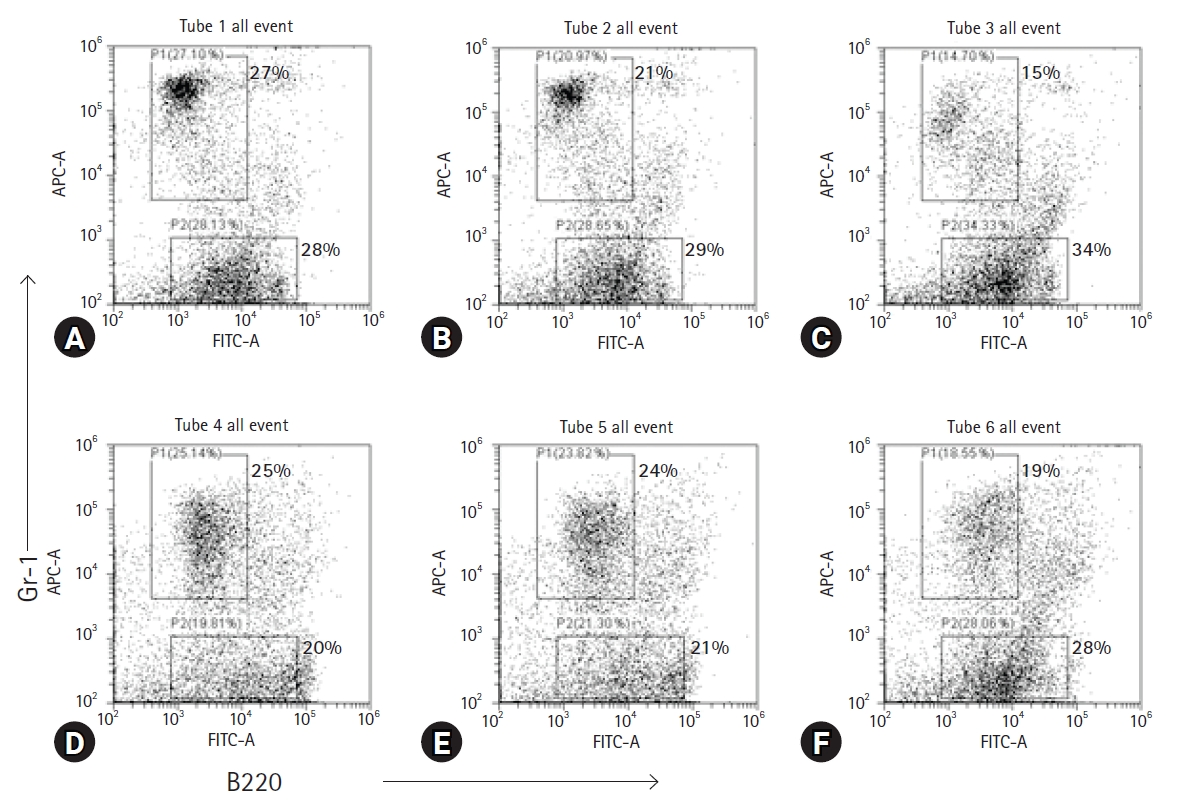
Fig.┬Ā5.
Fenbendazole (FBZ) increased the number of bone marrow cells (BMs) with fragmented nuclei. The cells were set up and treated with FBZ and lipopolysaccharide (LPS), as in Fig. 2. After 2 days, Hoechst 33342 staining was performed. The BMs treated with FBZ 1 ┬ĄM contain many cells with fragmented nuclei (arrows). (A) FBZ 0 ┬ĄM, (B) FBZ 0.25 ┬ĄM, (C) FBZ 1 ┬ĄM, (D) FBZ 0 ┬ĄM + LPS 1 ┬Ąg/mL, (E) FBZ 0.25 ┬ĄM + LPS 1 ┬Ąg/mL, and (F) FBZ 1 ┬ĄM + LPS 1 ┬Ąg/mL.
References
2. Pritchett KR, Johnston NA. A review of treatments for the eradication of pinworm infections from laboratory rodent colonies. Contemp Top Lab Anim Sci 2002;41:36-46.
3. Petersen MB, Friis C. Pharmacokinetics of fenbendazole following intravenous and oral administration to pigs. Am J Vet Res 2000;61:573-576.


4. Dawson PJ, Gutteridge WE, Gull K. A comparison of the interaction of anthelmintic benzimidazoles with tubulin isolated from mammalian tissue and the parasitic nematode Ascaridia galli. Biochem Pharmacol 1984;33:1069-1074.


5. Friedman PA, Platzer EG. Interaction of anthelmintic benzimidazoles and benzimidazole derivatives with bovine brain tubulin. Biochim Biophys Acta 1978;544:605-614.


6. Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep 2018;8:11926.



7. Hawkins MG, Couto S, Tell LA, Joseph V, Lowenstine LJ. Atypical parasitic migration and necrotizing sacral myelitis due to Serratospiculoides amaculata in a prairie falcon (Falco mexicanus). Avian Dis 2001;45:276-283.


8. Kim HJ, Kim MH, Byon YY, Park JW, Jee Y, Joo HG. Radioprotective effects of an acidic polysaccharide of Panax ginseng on bone marrow cells. J Vet Sci 2007;8:39-44.



9. Kim SY, Joo HG. Evaluation of adjuvant effects of fucoidan for improving vaccine efficacy. J Vet Sci 2015;16:145-150.



10. Moon SY, Joo HG. Anti-inflammatory effects of 4,4'-diaminodiphenyl sulfone (dapsone) in lipopolysaccharide-treated spleen cells: selective inhibition of inflammation-related cytokines. Korean J Vet Res 2015;55:199-204.

11. Jang JY, Moon SY, Joo HG. Differential effects of fucoidans with low and high molecular weight on the viability and function of spleen cells. Food Chem Toxicol 2014;68:234-238.


12. Cai Y, Zhou J, Webb DC. Treatment of mice with fenbendazole attenuates allergic airways inflammation and Th2 cytokine production in a model of asthma. Immunol Cell Biol 2009;87:623-629.


14. Rajamanickam A, Munisankar S, Bhootra Y, Dolla CK, Nutman TB, Babu S. Elevated systemic levels of eosinophil, neutrophil, and mast cell granular proteins in Strongyloides stercoralis infection that diminish following treatment. Front Immunol 2018;9:207.



15. Nehete PN, Wilkerson G, Nehete BP, Chitta S, Ruiz JC, Scholtzova H, Williams LE, Abee CR, Vanchiere JA. Cellular immune responses in peripheral blood lymphocytes of Giardia infected squirrel monkey (Saimiri boliviensis boliviensis) treated with Fenbendazole. PLoS One 2018;13:e0198497.



16. Landin AM, Frasca D, Zaias J, Van der Put E, Riley RL, Altman NH, Blomberg BB. Effects of fenbendazole on the murine humoral immune system. J Am Assoc Lab Anim Sci 2009;48:251-257.


17. Villar D, Cray C, Zaias J, Altman NH. Biologic effects of fenbendazole in rats and mice: a review. J Am Assoc Lab Anim Sci 2007;46:8-15.
- TOOLS
-
METRICS

-
- 1 Crossref
- 1 Scopus
- 3,080 View
- 48 Download
- ORCID iDs
-
Seo-Ro Park

https://orcid.org/0000-0002-6012-4668Hong-Gu Joo

https://orcid.org/0000-0002-1505-8761 - Related articles


 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print