Streptozotocin으로 유도된 당뇨 랫드에서 황칠나무 잎 열수추출물의 항당뇨 효과
Anti-diabetic effects of aqueous extract of Dendropanax morbifera Lev. leaves in streptozotocin-induced diabetic Sprague-Dawley rats
Article information
Abstract
This study examined the anti-diabetic effects of aqueous extracts of Dendropanax morbifera leaves (DMWEs) in streptozotocin-induced diabetic Sprague-Dawley (SD) rats. Thirty male SD rats (body weight [BW], 250.4 ± 19.7 g) were divided into the following six groups: normal control rats (NC), diabetic control rats (DC), diabetic rats treated with metformin HCl 100 mg/kg BW (DT), diabetic rats treated with DMWEs 50 mg/kg BW (DM-50), diabetic rats treated with DMWEs 100 mg/kg BW (DM-100), and diabetic rats treated with DMWEs 200 mg/kg BW (DM-200). From two weeks of administration of DMWEs, the BW of all groups treated with DMWEs increased significantly compared to DC (p < 0.05). At four weeks after treatment, the blood glucose levels in DT, DM-100, and DM-200 decreased below 200 mg/dL, while the glycated hemoglobin concentrations in all groups administered DMWEs were similar to those of NC and DT. Regarding the blood biochemical parameters, the levels of aspartate transaminase, alanine transaminase, blood urea nitrogen, and creatinine in DM-100 and DM-200 were similar to those in NC and DT. Overall, these results highlight the effectiveness of DM-100 in the treatment of diabetes.
서론
최근 식생활과 생활양식이 급속히 서구화되면서, 비만, 고혈압, 심혈관계 질환, 당뇨 등과 같은 만성 퇴행성 질환이 증가하고 있다. 특히, 당뇨병은 전 세계적으로 10대 사망원인 중의 하나로 유병률이 꾸준히 증가하고 있다. 앞선 연구에 따르면[1], 2019년 전 세계 당뇨병 환자수는 4억 6천 3백만 명으로 유병률이 9.3%라고 보고하였으며, 2030년에는 유병률이 10.2%까지 증가할 것으로 예측하였다. 우리나라의 경우, 당뇨병은 10대 사망원인 중 6위에 기록되었으며, 전체 사망자의 2.7%가 당뇨병으로 사망한 것으로 나타났다[2]. 또한 대한당뇨병학회에서 발표한 Korean diabetes fact sheet에 따르면, 국내 30세 이상 성인 7명 중 1명은 당뇨병 환자이고, 30세 이상 당뇨병 환자 501만 명 중 약 20%인 98만 명은 40대 이하인 것으로 나타났다[3].
당뇨병은 체내 인슐린 분비와 활성에 장애가 생긴 만성 대사성 질환이다. 체내 인슐린 분비 부족은 만성 고혈당증, 탄수화물 및 지질 대사 이상, 골격근, 지방조직, 간 등의 대사신호전달 및 변환 체계 이상 등을 유발하게 된다[4]. 당뇨병은 제1형 당뇨병과 제2형 당뇨병으로 분류할 수 있다. 제1형 당뇨병은 췌장 β세포의 손상으로 인슐린 분비가 되지 않아 당 대사 장애가 일어난 상태이며, 제2형 당뇨병은 β세포 기능 장애는 없으나 각 장기에서의 인슐린 수용체에 저항성이 생겨 인슐린의 작용이 원활하지 못해 당 대사 장애가 발생한 상태이다[5]. 제2형 당뇨병에서의 고혈당 현상은 당 대사를 통해 체내 에너지를 생산하지 않고 지질 대사에 의존함으로써 혈중 지질 농도를 증가시켜 심혈관계 질환, 안과 질환, 신장 질환 등의 합병증을 유발하는 것으로 알려져 있다[6].
대부분 당뇨병 치료를 위해 식이조절과 운동요법을 수행하면서, 인슐린 억제제 또는 경구용 혈당강하제를 병용하고 있지만, 경구용 혈당강하제는 극심한 유산혈증과 저혈당과 같은 부작용을 동반하는 것으로 알려져 있다[7]. 이런 부작용으로 인해, 최근에는 acarbose와 같은 α-glucosidase 저해제가 사용되고 있는데, 이 저해제는 소장에서 α-glucosidase의 기능을 억제하고 포도당 흡수를 지연시켜 식후 고혈당 및 고인슐린 혈증을 개선하는 동시에 저혈당이 유발되지 않도록 해주는 장점이 있는 것으로 보고되었다[8]. 하지만 이러한 약물들은 장기간 복용하게 되면 속 쓰림, 메스꺼움, 구토, 설사, 저혈당, 체중 증가, 간 독성, 젖산혈증 등과 같은 부작용으로 인해 사용상에 제한이 있다[9]. 따라서 이같은 부작용을 감소시키고 장기복용에도 부작용이 없이 안전한 당뇨병 치료제의 개발이 요구되고 있다.
세계보건기구에서는 당뇨병의 치료에 효과가 있고 부작용이 적은 천연물의 이용을 적극적으로 추천한 바 있어[10], 최근에는 기존 당뇨병 치료제를 대체하기 위해 천연물로부터 당뇨병 치료 약물을 탐색하기 위한 연구들이 활발하게 진행되고 있다[11-13].
황칠나무(Dendropanax morbifera Lev.)는 두릅나무과(Araliaceae)에 속하는 아열대성 상록활엽교목으로 동남아시아 등에 약 30여 종이 분포하고 있다. 그 중 우리나라에 서식하는 황칠나무는 1속 1종의 수종으로 온화한 기후의 남서해안 지역과 제주도에서만 자생하고 있다[14]. 황칠나무의 수피에 상처를 내면 황색의 수지액이 나오는데 이것을 황칠이라고 하며, 목재나 금속 또는 유리 등에 광범위하게 쓰일 수 있는 천연도료로, 건조나 부착성이 좋고 진정, 안정 효과가 있는 물질을 포함하고 있어서 칠을 하고 나면 안식향이 발산되는 것으로 알려져 있다[15]. 앞선 연구에서, 황칠나무 수지액의 주성분은 polyacetylenes계 화합물질로서 식물이 외상과 같은 외부 자극을 받으면 분비되는 항균성 물질인 것으로 보고되었으며[16], 주요 정유성분으로는 β-elemene, germacrene D, β-selinene, α-selinene, γ-cadinene, δ-cadinene 등이었으며, 이 중에서도 germacrene D가 주요 구성 성분이라고 보고하였다[17].
따라서 본 연구에서는 다양한 효능을 갖고 있는 황칠나무 잎의 열수추출물(aqueous extracts of Dendropanax morbifera leaves, DMWEs)을 이용하여 당뇨병을 유발시킨 흰쥐를 대상으로, 체중 변화, 혈당 농도 변화, 혈중 당화혈색소(glycated hemoglobin, HbA1c) 농도 변화, 혈액생화학적 변화 등에 대해 조사함으로써 당뇨병에 대한 치료효과를 확인하였다.
재료 및 방법
실험동물
7주령의 specific pathogen free (SPF) Sprague-Dawley 수컷 쥐 30마리(체중, 250.4 ± 19.7 g)를 샘타코사(Korea)로부터 구입하여, SPF 상태를 확인하기 위한 미생물학적 검사를 실시하여 병원체가 없는 것을 확인한 후 실험에 사용하였다. 쥐는 5마리씩을 임의로 선택하여 케이지에 분리하여, 1주일 동안 적응을 시킨 후 실험에 사용하였다. SPF 상태를 유지하기 위해 음수, 사료, 깔짚 등은 모두 고압멸균 후 사용하였으며, 사료와 음수는 자유롭게 섭취하도록 하였다. 사육 온도와 습도는 각각 23℃ ± 1.0℃와 50% ± 10%로 하였으며, 환기는 자동으로 조절되는 실험동물 사육장치(쓰리샤인, Korea)에서 사육하였다. 본 실험은 국립경상대학교의 실험동물윤리위원회의 승인을 받아 본 위원회의 규정에 의거하여 수행하였다(GNU-210210-R0014).
황칠나무 잎 추출
황칠나무 잎은 경상남도 하동에서 재배된 것을 휴림황칠(Korea)로부터 제공받아 실험에 사용하였다. 제공받은 황칠나무 잎은 냉암소에서 건조시킨 후, 건조 시료 100 g에 10배(w/w)의 증류수를 가하여 환류추출장치를 이용하여 80℃에서 3시간 동안 추출한 다음, 여과지(Whatman No. 2; Merck, Germany)로 여과하였다. 이어서 여액을 50℃ 수욕상에서 rotary vacuum evaporator (EYELA, USA)로 감압•농축한 후, 동결건조기(Labconco Corp., USA)를 이용하여 동결건조하여, 4℃ 이하로 냉장보관하면서 실험에 사용하였다. DMWEs의 수율은 14.3%였다.
실험군 설정 및 시험물질 투여
각 군 당 5마리씩으로 군 당 체중이 고르게 분포하도록 하여, 실험군을 6개로 구성하였다. 정상 대조군(normal control group, NC)은 당뇨를 유발시키지 않고, 4주 동안 매일 일정시간에 증류수 0.1 mL를 투여하였으며, 당뇨 대조군(diabetic control group, DC)은 당뇨를 유발시켜 증류수 0.1 mL를 투여하였다. 약제 투여군(drug treatment group, DT)은 당뇨약으로 사용되는 metformin HCl (500 mg, 다이아벡스; 대웅제약, Korea)을 100 mg/kg body weight (BW)로 4주 동안 투여하였으며, DMWEs 투여군(DM-50, DM-100, DM-200)은 각각 DMWEs를 50, 100, 200 mg/kg BW로 4주 동안 경구 투여하였다. DT의 투여 용량은 Mali 등[18]의 연구를 참고하여 설정하였으며, DMWEs 투여군의 투여 용량은 Ahn 등[17]의 연구를 참고하여 설정하였다.
당뇨병 유발
앞선 연구[19]을 참고하여, 0.1 M의 citrate buffer (pH 4.5)에 streptozotocin (STZ; Merck)을 용해시켜 60 mg/kg BW을 쥐의 복강에 1회 주입하였다. STZ 주입 1주일 후, 모든 실험동물들의 꼬리에서 혈액을 채취하여 혈당측정기(Accu-Check Active; Roche, Switzerland)를 이용하여 혈당을 측정하여, 당뇨병 기준 혈당인 200 mg/dL 이상을 확인한 다음[20], 약제 투여를 시작하였다.
혈당 측정
모든 실험동물에 대해, 시험물질을 투여하기 전과 시험물질 투여 후, 매 1주일 간격으로 꼬리에서 혈액을 채취하여 혈당측정기(Accu-Check Active)를 이용하여 혈당을 측정하여 기록하였다.
혈액 채취
실험동물의 혈액을 채취하기 위하여 실험 종료 12시간 동안 절식을 시킨 후, diethyl ether (Sigma-Aldrich Korea, Korea)로 마취시킨 다음, 심장천공법을 이용하여 혈액을 채취하였다. 채취한 혈액은 heparin이 처리된 혈액채취 튜브(BD Vacutainer; BD Korea, Korea)에 담아, 전혈은 HbA1c 측정에 사용하였고, 나머지는 상온에 1시간 동안 방치한 후, 3,000 rpm에서 10분 동안 원심분리하여 혈청을 분리하여 혈액생화학적 분석에 사용하였다.
HbA1c 측정 및 혈액생화학적 분석
HbA1c는 실험동물로부터 채취한 혈액을 A1c 측정용 카트리지에 주입한 후, 당화혈색소 측정기(Easy A1c; Asan Pharmaceutical, Korea)를 이용하여 측정하였다. 분리한 혈청을 혈액자동생화학분석기(Hitachi 911 chemistry analyzer; Hitachi, Japan)를 이용하여, aspartate transaminase (AST), alanine transaminase (ALT), blood urea nitrogen (BUN)과 creatinine의 농도를 각각 측정하였다.
통계분석
통계적 분석은 SPSS 12.0 for Windows (SPSS Inc., USA)를 이용하여, 실험군들 간의 차이를 비교하기 위하여 일원배치분산분석(one-way analysis of variance, ANOVA)으로 검증하였다. 각 그룹 간의 차이를 검증하기 위하여 Duncan multiple range test를 이용하여 분석을 실시하였고 통계적 유의수준은 p < 0.05로 하였다.
결과
체중 변화
Fig. 1은 DMWEs의 투여 용량에 따른 경시별 쥐의 체중 변화를 나타낸 것이다. NC, DT, DM-200은 경시별로 체중이 증가하는 경향을 나타낸 반면에, DC와 DM-50은 경시별로 체중이 감소하는 경향을 나타내었다. 약제 투여 7일 후에는, 모든 DMWEs 투여군들(DM-50, DM-100, DM-200)의 체중은 DT의 체중과 비교하여 통계적으로 유의적인 차이를 보이지 않았으나, DM-100과 DM-200의 체중은 DC와 비교하여 통계적으로 유의성 있게 증가하였다(p < 0.05). 약제 투여 14일 이후에는, 모든 DMWEs 투여군들의 체중은 DC의 체중과 비교하여 통계적으로 유의성 있게 증가하였으나(p < 0.05), DM-100과 DM-200의 체중은 DT와 비교하여 통계적으로 유의한 차이를 보이지 않았다.

Changes in the body weight (BW) in male Sprague-Dawley rats administered aqueous extracts of Dendropanax morbifera leaves (DMWEs) for 28 days. ■ (NC), normal control given distilled water; ○ (DC), streptozotocin (STZ)-induced diabetic rats given distilled water; ▲ (DT), STZ-induced diabetic rats given metformin HCl with 100 mg/kg BW; ▼ (DM-50), STZ-induced diabetic rats given DMWEs with 50 mg/kg BW; ◆(DM-100), STZ-induced diabetic rats given DMWEs with 100 mg/kg BW; ● (DM-200), STZ-induced diabetic rats given DMWEs with 200 mg/kg BW. a-cMean values (mean ± SD) with different superscripts within the same day are significantly different at the p < 0.05 level by Duncan multiple range test.
혈당 변화
Table 1은 DMWEs를 4주 동안 투여하면서 매주 쥐의 혈당을 측정한 결과를 나타낸 것이다. 실험기간 동안, DMWEs를 투여한 모든 군과 DT의 혈당은 DC와 비교하여 통계적으로 유의성 있게 감소하는 결과를 보였다(p < 0.05). 약제 투여 후 3주째에, DM-200과 DT의 혈당은 정상범위(200 mg/dL)로 감소하였으며, 약제 투여 후 4주째에는 DM-100, DM-200, DT의 혈당 수치가 정상범위 내로 감소하였다.
HbA1c 농도
Fig. 2는 DMWEs 투여 4주 후 심장천공법으로 채취한 혈액에 대해 HbA1c 농도를 분석한 결과를 나타낸 것이다. DMWEs를 투여한 모든 군들의 HbA1c 농도는 NC와 DT의 값과 비교하여 통계적으로 유의적인 차이를 나타내지 않았다. DM-100과 DM-200의 HbA1c 농도는 DC의 값과 비교하여 통계적으로 유의성 있게 감소하는 결과를 보였다(p < 0.05).
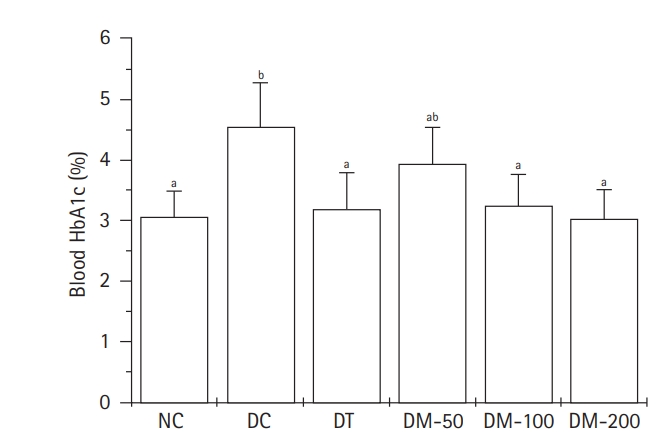
Blood glycated hemoglobin (HbA1c) level in streptozotocin-induced diabetic rats administered aqueous extracts of Dendropanax morbifera leaves (DMWEs) for four weeks. DMWEs, Dendropanax morbifera leaves; NC, normal control given distilled water; DC, streptozotocin (STZ)-induced diabetic rats given distilled water; DT, STZ-induced diabetic rats given metformin HCl with 100 mg/kg body weight (BW); DM-50, STZ-induced diabetic rats given DMWEs with 50 mg/kg BW; DM-100, STZ-induced diabetic rats given DMWEs with 100 mg/kg BW; DM-200, STZ-induced diabetic rats given DMWEs with 200 mg/kg BW. a.bMean values (mean ± SD) with different superscripts are significantly different at the p < 0.05 level by Duncan multiple range test.
혈액생화학적 분석
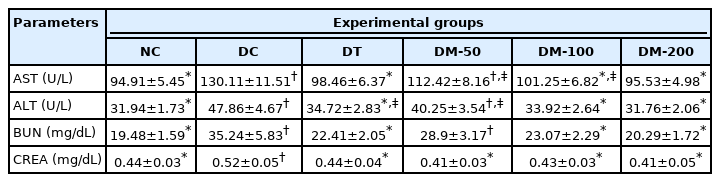
Table 2는 DMWEs 투여 4주 후 심장천공법으로 채취한 혈액을 원심분리하여 혈청을 분리한 후, 쥐의 혈액생화학학적 지표들을 분석한 것을 나타낸 것이다. DMW를 투여한 모든 군과 DT의 creatinine 농도는 DC의 농도와 비교하여 통계적으로 유의성 있게 감소하였다(p < 0.05). DM-100과 DM-200에서 AST, ALT, BUN 농도는 NC와 DT와 비교하여 통계적으로 유의적인 차이를 보이지 않았으나, DC와 비교해서는 통계적으로 유의성 있게 감소하는 결과를 나타내었다(p < 0.05).
고찰
당뇨병은 췌장의 β세포 기능저하로 인해 당 대사와 관련된 효소의 활성을 정상적으로 유도하지 못하는 질환으로, 에너지원으로 사용되어야 하는 당이 세포 속으로 충분히 흡수되지 못하므로 당의 이용률이 낮아져 혈당치가 높아지는 질병이다[16]. 당뇨병은 대사 장애로 식후 혈당 수준의 비정상적인 증가를 특징으로 한다[21]. 음식 섭취 후 혈당 수준을 효과적으로 제어하기 위하여 천연 공급원으로부터 얻은 acarbose 및 voglibose 등이 당뇨병의 치료에 임상적으로 사용되어왔다[22]. 하지만 위장관에서의 부작용으로 인해 약물의 안전성 문제가 제기됨에 따라 치료의 효과를 높이고 부작용이 없는 천연물을 이용한 대안적 소재들에 대한 요구가 증가하고 있다[19]. 본 연구에서는 우리나라 고유 수종인 황칠나무의 DMWEs를 당뇨 유발 쥐에 투여하여 항당뇨 효과를 확인하기 위해 수행되었다.
황칠나무는 예로부터 잎, 줄기, 뿌리 등 다양한 부분들이 아토피 피부염, 천식, 인후염, 빈혈, 정신병, 바이러스 감염 및 신장 질환들을 치료하는 데 일반적으로 사용되었다[23-25]. 앞선 많은 연구들에서, 황칠나무는 항산화 효과[26], 신장보호 효과[27], 항당뇨 효과[28] 그리고 항암 효과[26] 등이 있는 것으로 보고되었다. 최근 황칠나무의 잎은 잠재적으로 해마 기능을 개선하고[29], 쥐에서 수은에 의한 신경 독성을 완화시키는 것으로 보고되었다[27]. 또한 DMWEs가 쥐에서 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine에 의해 유도된 미크로글리아(microglia)에서의 신경-염증 매개 활성을 현저하게 감소시키고, 행동 결손을 회복시켰다고 보고하였다[30].
앞선 연구에서[31], STZ (70 mg/kg)를 5일 동안 복강에 투여하여 당뇨를 유발시킨 쥐에 2주 동안 DMWEs (100, 200 mg/kg BW)과 70% 에탄올 추출물(100, 200 mg/kg)을 경구 투여한 결과, 시험기간 동안, 황칠나무 추출물들을 투여한 모든 군들의 체중이 당뇨 유발 대조군과 비교하여 통계적으로 유의성 있게 증가하였다고 보고하였다(p < 0.05). 다른 앞선 연구에서[28], STZ (70 mg/kg)를 1회 복강에 투여하여 당뇨를 유발시킨 쥐에 2주 동안, 황칠나무 잎 추출물로부터 분리한 dendropanoxide를 30, 60, 100 mg/kg BW로 경구 투여한 결과, 2주째에 dendropanoxide를 투여한 모든 군들의 체중이 당뇨 유발 대조군과 비교하여 통계적으로 유의적인 차이가 없었다고 보고하였다. 본 연구에서도 An 등[31]의 연구결과와 같이 DMWEs를 투여한 군들의 체중이 당뇨 유발 대조군과 비교하여 통계적으로 유의성 있게 증가하는 결과를 보였다(p < 0.05). 또한 당뇨 유발 쥐에서 DMWEs가 dendropanoxide보다 체중 증가에 더 효과적인 것으로 판단된다. 대표적인 항당뇨 활성을 가진 바나바(banaba)로 불리는 Lagerstroemia speciosa는 많은 연구들을 통해 혈당조절 효과가 검증된 식물이다. Singh 등[32]은 L. speciosa 잎을 탈지방화시킨 다음, 열수추출한 추출물을 100과 200 mg/kg BW 농도로 당뇨를 유발시킨 쥐에 14일 동안 투여한 결과, 14일째에 정상 대조군의 체중과 비교해서는 통계적으로 유의성 있게 감소하였으나(p < 0.05), 당뇨 치료제인 glibenclamide (0.25 mg/kg BW)를 투여한 군의 체중과 비교해서는 통계적으로 유의한 차이를 보이지 않았다고 보고하였다. 본 연구에서도 DM-100과 DM-200의 체중은 당뇨 치료제인 metformin HCl을 투여한 군(DT)의 체중과 비교해서 통계적으로 유의적인 차이를 보이지 않아, 앞선 연구와 유사한 결과를 보였다.
앞선 연구에서[31], DMWEs와 에탄올 추출물을 각각 100과 200 mg/kg의 농도로 STZ로 당뇨를 유발시킨 쥐에 14일 동안 경구 투여한 결과, DMWEs를 투여한 모든 군들의 혈당 농도가 당뇨 유발 쥐의 혈당 농도에 비해 통계적으로 유의성 있게 감소하였다고 보고하였다(p < 0.05). 다른 선행 연구에서[33], 당뇨 유발 쥐에 DMWEs를 100과 300 mg/kg 농도로 11주 동안 경구 투여한 결과, DMWEs를 투여한 군에서의 혈당 농도는 당뇨 유발 대조군에 비해 통계적으로 유의성 있게 감소하였다고 보고하였다(p < 0.05). 또한 황칠 발효액을 이용한 연구에서[29], 황칠나무 잎을 대나무 발효액과 대나무 수액과 같이 발효시킨 발효액을 200과 400 mg/kg 농도로 6주 동안 당뇨 유발 쥐에 경구 투여한 결과, 모든 황칠나무 잎 발효액 투여군의 혈당 농도가 당뇨 유발 대조군의 혈당 농도에 비해 통계적으로 유의성 있게 감소하였다고 보고하였다(p < 0.05). 한편, DMWEs를 이용한 연구에서[34], DMWEs (50 mg/kg)와 metformin HCl (50 mg/kg)을 당뇨 유발 쥐에 4주 동안 경구 투여한 결과, 4주째에 당뇨를 유발하지 않은 무투여 대조군의 혈당 농도와 통계적으로 유의적인 차이를 보이지 않았으며, DMWEs를 투여한 군의 혈당 농도가 metformin HCl 투여군의 혈당 농도와 비교하여 상대적으로 낮은 결과를 보였다고 보고하였다. 본 연구에서 DM-100과 DM-200을 4주 동안 투여한 경우의 혈당 농도는, 앞선 연구들과 같이, 당뇨 유발 대조군의 혈당 농도에 비해 통계적으로 유의성 있게 감소하였다(p < 0.05). 특히 DMWEs를 50 mg/kg 농도로 투여한 연구[34]의 경우는 본 연구의 결과에 비해 혈중 농도의 감소 효과가 뛰어난 것으로 나타났는데, 이는 황칠나무 잎을 채취한 지역별, 시기별 그리고 추출용매별로 유효성분의 함량에 차이를 보이기 때문인 것으로 판단된다[35].
HbA1c는 장기간 동안 혈중 혈당 농도를 알기 위해 사용하는 혈색소의 한 형태로 당뇨 환자에서 혈당이 잘 조절되지 않을 경우 HbA1c의 수치가 증가하게 되므로, 당뇨 환자의 혈당조절 여부를 확인하기 위해 HbA1c를 측정하여 확인하고 있다[36]. 앞선 연구에서[37], 황칠나무과 같이 두릅나무과에 속하는 오가피나무의 잎을 열수추출한 추출물을 당뇨를 유발시킨 Wistar계 쥐에 사료 kg 당 11.42 g을 혼합하여 7주 동안 투여한 결과, HbA1c 농도가 당뇨 유발 대조군에 비해 통계적으로 유의성 있게 감소하였다고 보고하였다(p < 0.05). 한편, 당뇨 유발 쥐에 metformin을 투여한 연구에서[12], 당뇨 유발 쥐에 metformin을 150 mg/kg으로 15일 동안 투여한 결과, 당뇨 유발 대조군의 HbA1c 농도와 비교하여 통계적으로 유의성 있게 감소하였으나, 대조군보다는 통계적으로 유의성 있게 높았다고 보고하였다(p < 0.05). 본 연구에서도 DM-50의 HbA1c 농도는 당뇨 유발 대조군과 비교하여 통계적으로 유의적인 차이를 보이지 않았으며, NC와 DT와도 통계적으로 유의적으로 유의적인 차이를 보이지 않았다. 앞선 연구에서[12], 본 연구에서보다도 높은 metformin 농도를 투여했음에도 HbA1c 농도가 정상 대조군보다 높았던 것은 투여기간이 본 연구와 비교하여 약 반 정도로 짧아서 이러한 결과가 나타난 것으로 판단된다.
STZ에 의해 당뇨병이 유도된 쥐의 경우, 간문맥과 간동맥의 손상과 간 세포 사이의 밀도 감소, 염증세포 침윤 등이 일어나며[38], 신장조직에서 사구체 기저막 비후, 섬유화, 사구체 경화증 등이 유발된다고 알려져 있다[39]. Sachan 등[34]은 DMWEs를 25 mg/kg BW로 4주 동안 당뇨 유발 쥐에 투여한 결과, AST, ALT, BUN, creatinine 농도가 당뇨 유발 대조군에 비해 통계적으로 유의성 있게 감소하였다고 보고하였다(p < 0.01). Moon [28]은 당뇨 유발 쥐에 dendropanoxide를 100 mg/kg BW로 2주 동안 복강 내로 투여한 결과, AST (p < 0.001), ALT (p < 0.01), creatinine (p < 0.05) 값이 당뇨 유발 대조군과 비교하여 통계적으로 유의성 있게 감소하였다고 보고하였다. 앞선 연구들과 같이, 본 연구에서는 DM-50의 creatinine 값과, DM-100과 DM-200의 AST, ALT, BUN, creatinine 값은 모두 DC와 비교하여 통계적으로 유의성 있게 감소하여(p < 0.05), DMWEs는 당뇨 유발 쥐에서 간과 신장 손상을 개선시키는 것으로 확인되었다.
이상의 연구결과로부터, DM-100은 혈당과 HbA1c 값을 정상범위로 저하시키고, 혈액생화학적 지표값들을 개선시켜 당뇨병 치료에 효과가 있는 것으로 확인되어, 당뇨병 치료를 위한 대체 보조제로 활용이 가능할 것으로 판단된다. 본 연구에서는 DMWEs의 항당뇨 작용기전 및 항당뇨 효과 유효물질에 대한 규명이 이루어지지 못한 연구의 한계점이 있어서, 향후, DMWEs의 항당뇨 작용기전 및 유효물질에 대한 규명이 필요할 것으로 판단된다.
Notes
The authors declare no conflict of interest.