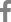|
 |
| Korean J Vet Res > Volume 63(3); 2023 > Article |
|
Abstract
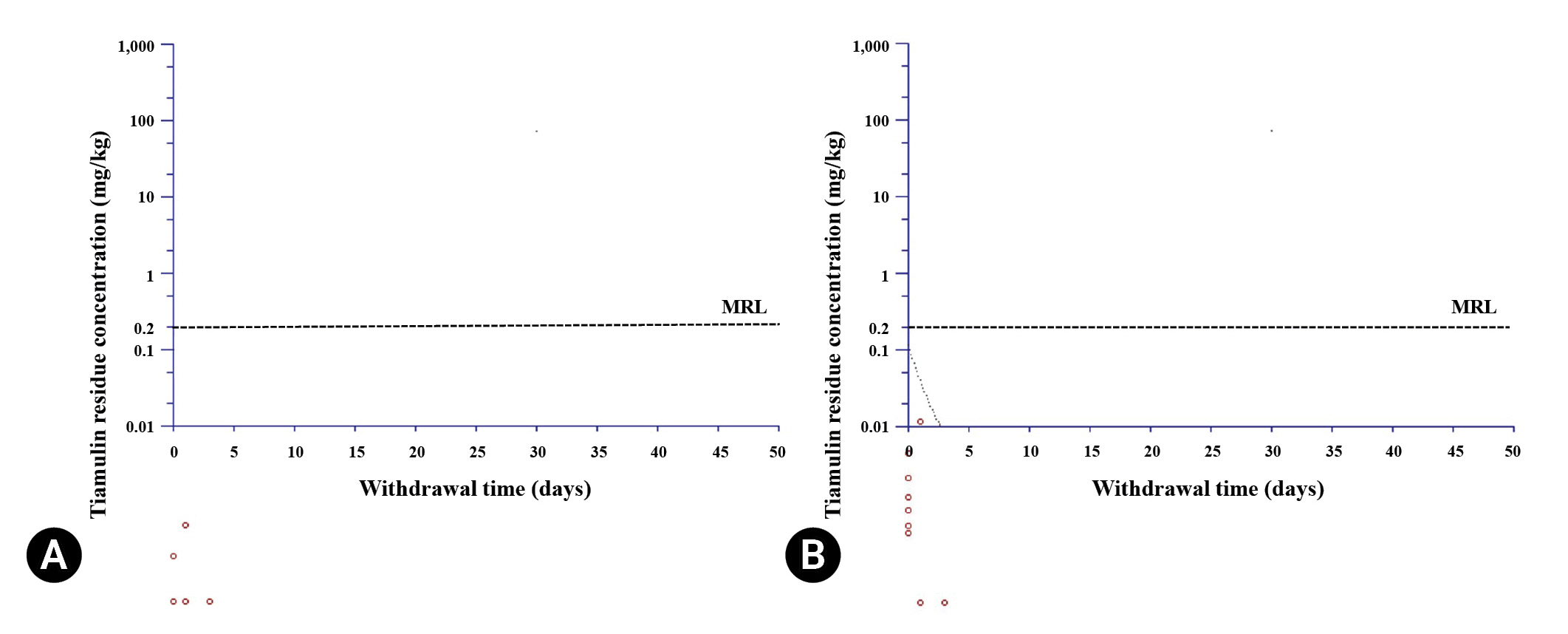
Fig.┬Ā1.
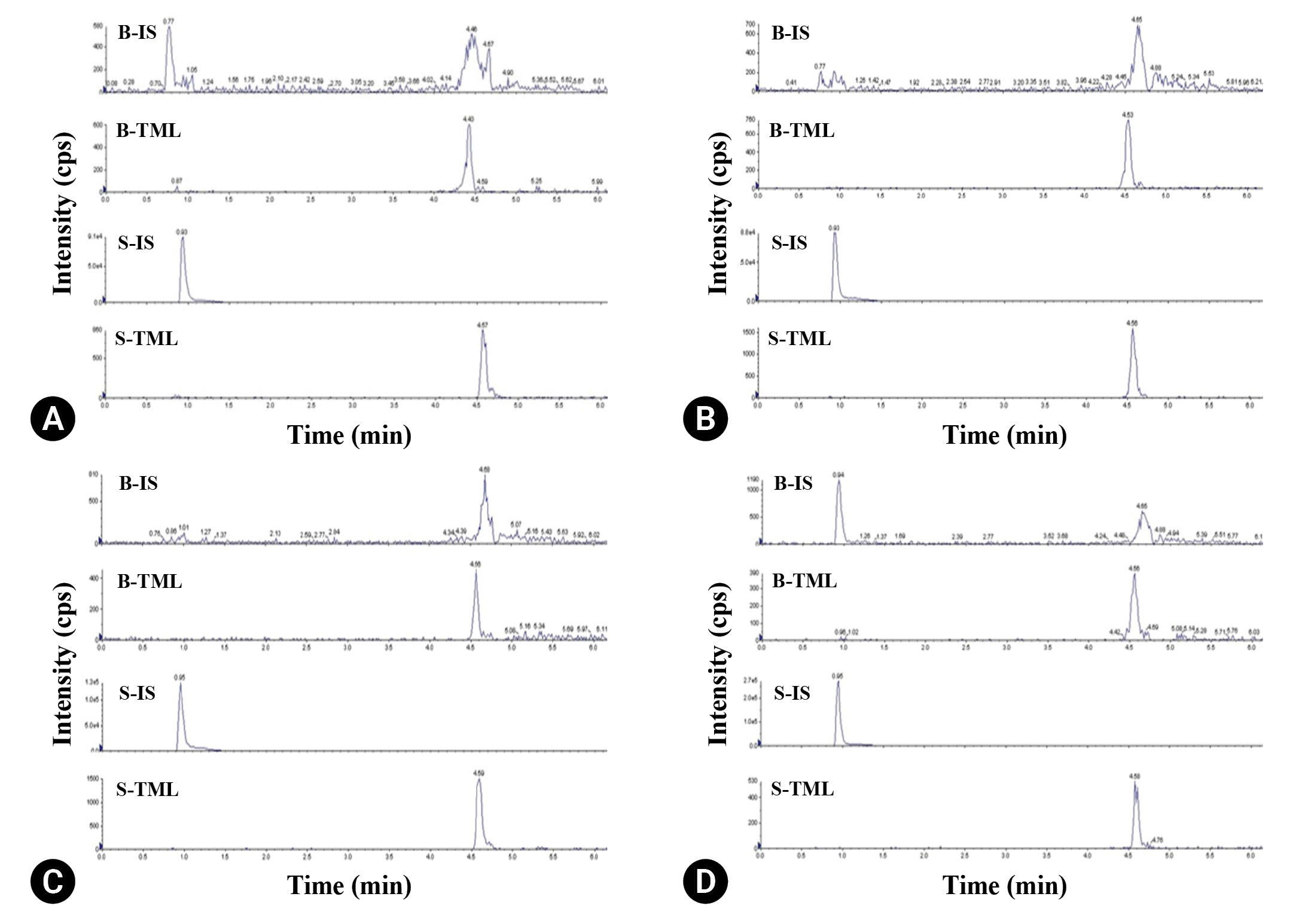
Fig.┬Ā3.
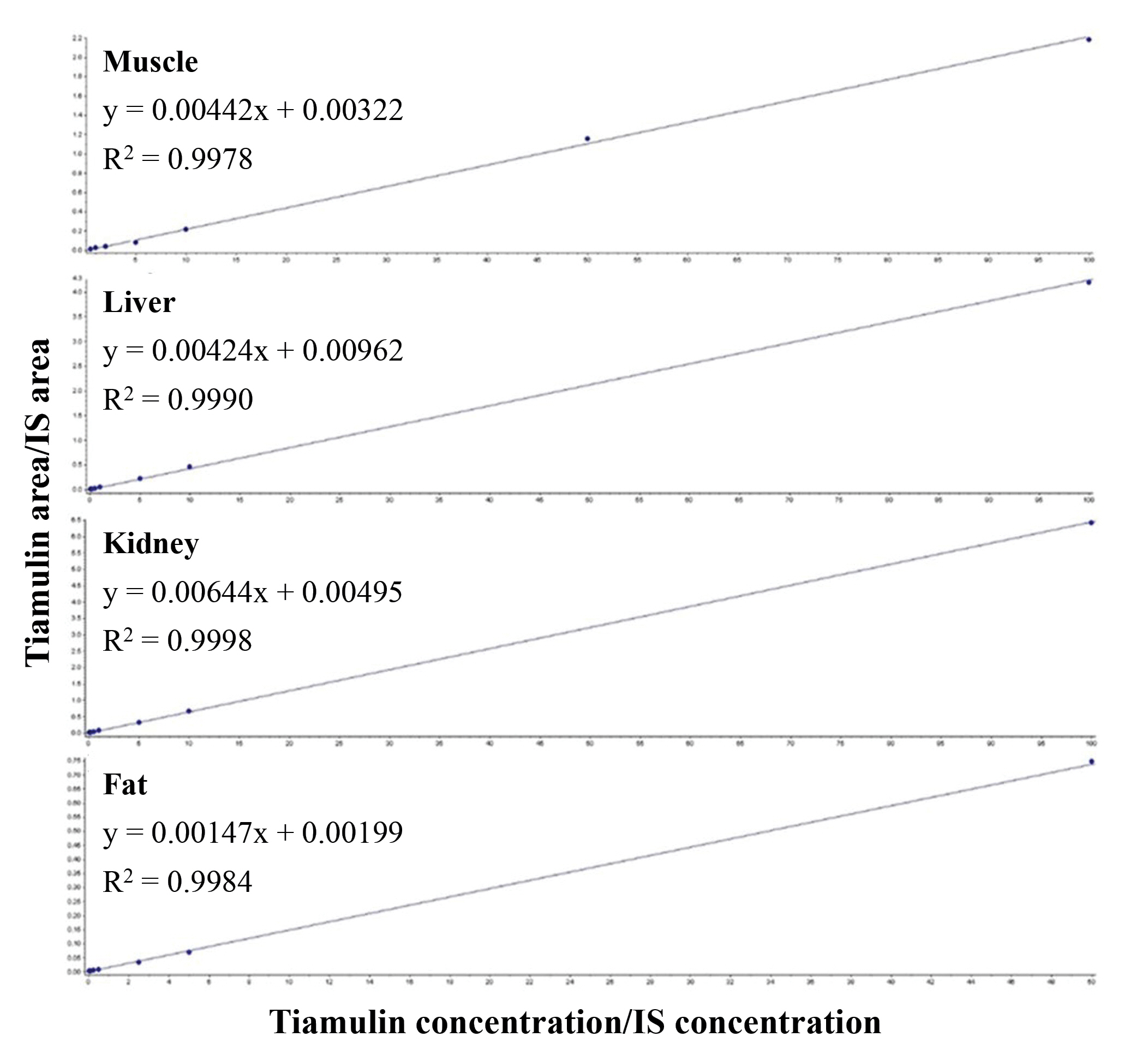
Table┬Ā1.
Table┬Ā2.
| Tissues | No. |
0* |
1* |
3* |
5* |
||||
|---|---|---|---|---|---|---|---|---|---|
| TML-1 | TML-2 | TML-1 | TML-2 | TML-1 | TML-2 | TML-1 | TML-2 | ||
| Muscle | 1 | <LOQ | 0.4 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | <LOQ | 0.5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Liver | 1 | <LOQ | 2.1 | 0.5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | <LOQ | 4.5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | <LOQ | 1.2 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | <LOQ | 0.8 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | <LOQ | 0.4 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | 2 | 0.5 | <LOQ | 11.4 | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | <LOQ | 1.6┬▒1.6┬Ā | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Kidney | 1 | <LOQ | 1.3 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | <LOQ | 0.3 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Fat | 1 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ |
| 2 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 3 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 4 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 5 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| 6 | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
| Mean┬▒SD | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | <LOQ | |
References
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,058 View
- 31 Download
- ORCID iDs
-
Woo H. Kim

https://orcid.org/0000-0002-6874-6787Jun Young Kim

https://orcid.org/0009-0004-7222-8351Kwang Il Park

https://orcid.org/0000-0002-0199-8090Yeung Bae Jin

https://orcid.org/0000-0001-6783-7970Suk Kim

https://orcid.org/0000-0003-3474-9047Hu-Jang Lee

https://orcid.org/0000-0002-7552-6416 - Related articles


 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print