제주도의 돼지유행성설사 발생 상황과 병리학적 고찰
Prevalence and pathologic study of porcine epidemic diarrhea in Jeju
Article information
Trans Abstract
From April 2014 to September 2015, 153 piglets from 52 farms in Jeju were diagnosed with porcine epidemic diarrhea (PED). The major PED cases were focused on suckling piglets (144 piglets, 94.1%), particularly in 1-7-day-old piglets. Histopathologically, severe villous atrophy was observed in the small intestine, especially in the jejunum and ileum. The mean villous height to crypt depth ratios of the jejunum and ileum were 1.4:1 and 1.5:1, respectively. The major histopathologic findings of the small intestine were cytoplasmic vacuolation, cuboidalization, squamation, and exfoliation of the mucosal enterocytes in the villi. The cytoplasmic vacuolations in the enterocytes were the most prevalent lesions in the small intestine and were more severe in the ileum than in the jejunum. According to immunohistochemistry methods, the PED virus (PEDV) antigens were presented in the cytoplasms of the enterocytes, and were distributed more prevalently in the ileum than in the jejunum. PEDV antigens were also detected in the colon of 26 piglets (19.5%). Sequence comparison and phylogenetic analysis indicated that 12 PEDV had more than a 98.9% homology with each other. These PEDV strains were highly homologous with the genogroup 2 North American group.
서론
돼지유행성설사바이러스(porcine epidemic diarrhea virus, PEDV)는 Nidovirales목 Coronaviridae과 Alphacoronavirus속에 속하는 외피를 가지는 단일가닥의 RNA 바이러스로서 원형이며 외곽에 왕관모양으로 다수의 스파이크를 가지는 것이 특징이다[1]. PEDV는 돼지전염성위장염바이러스(transmissible gastroenteritis virus, TGEV)와 같은 코로나바이러스이지만 항원성이 상이하다. PED는 1971년 영국에서 최초로 발생하여 포유자돈을 제외한 육성 비육돈에서 급성 설사증을 나타내어 기존에 알려져 있는 TGE와 매우 유사한 증상을 나타내었다[2]. 이후 다른 유럽 국가들로 전파되어 이 질병을 epidemic viral diarrhea (EVD)로 명명하였다. 그 후 1976년 영국에서 포유자돈을 포함한 모든 연령층의 돼지에서 급성 설사증이 발생하였다. 이러한 두 번의 설사증 발생 돼지에서 TGEV와 기타 장병원성 원인체는 검출되지 않았으며, 두 질병을 구분하기 위하여 1971년 발생한 설사증은 EVD 1형으로, 1976년 발생 설사증은 EVD 2형으로 명명하였다. 이후 EVD 2 발생 돼지에서 코로나바이러스 유사 병원체가 분리되었고, 이 바이러스가 EVD 1 발생에도 관여하였던 점이 밝혀져 이 설사병을 PED로 명명할 것을 제안하였으며, 현재까지 전 세계적으로 통용되고 있다[2].
아시아에서는 일본에서 1983년 발생 보고가 있었으며[3], 국내에서는 1992년 설사 증상을 보이는 자돈으로부터 PEDV를 처음으로 분리하였다[4]. 수의과학연구소(현 농림축산검역본부)의 보고에 따르면, 1992년 1월부터 1993년 12월까지 의뢰된 71건의 바이러스성 설사 예 중 56.3%가 PED로 진단되었으며, 그 중 90% 정도가 10일령 이하의 포유자돈에 집중되어 있었다[5]. 그 이후에는 전국적으로 확산되어 지속적으로 발생하였으나 2011-2012년 사이에는 다소 소강상태를 나타내었다. 그러나 2013년부터 전국 양돈 농가에서 PED가 재발하고 빠르게 확산되어 큰 경제적 피해를 주고 있다[6,7]. 제주에서는 PED가 2004년 3월 마지막으로 발생한 후 약 10년간 미발생이었으나, 2014년 4월부터 다시 발생하여 현재까지 양돈 산업에 큰 타격을 주고 있는 실정이다.
따라서 본 연구는 제주지역의 재발생 시점인 2014년 4월부터 18개월 동안의 PED 발생 상황을 분석하고, 감염된 돼지에 대한 병리학적 검사와 함께 분리된 바이러스에 대한 유전학적 분석을 실시하였다. 또한 중국과 미국에서 발생하였던 PEDV와 제주에서 분리된 바이러스의 유전형을 비교하고자 하였다.
재료 및 방법
공시재료 및 PED 발생 현황 조사
공시동물은 2014년 4월부터 2015년 9월까지 제주도 내 양돈 농가 52호에서 72회에 걸쳐 제주특별자치도 동물위생시험소에 병성감정 의뢰된 돼지 153마리를 대상으로 하였다. 농가에서 의뢰된 돼지에 대한 PED 진단은 역전사 중합효소연쇄반응(reverse transcription polymerase chain reaction, RT-PCR) 검사 결과를 토대로 최종 확진하였다. PED로 진단된 돼지를 연령별, 계절별 및 지역별로 구분하여 발생 상황을 분석하였다.
육안검사
동물위생시험소에 의뢰된 돼지에 대하여 임상증상을 확인하고, 외관 검사 후 일반적인 부검술식에 따라서 내부장기의 병변을 관찰하였다. 특히 위장관을 포함한 소화기계의 변화상을 면밀히 관찰하였다. 의뢰된 돼지의 육안 병변 발생 빈도를 포유 연령에 따라 4일령 미만, 4일 이상 7일 이하, 8일 이상으로 세분하여 비교하였다.
병리조직학적 검사
돼지 부검 시 주요 내부 실질 장기를 채취하였다. 특히, 소화기계는 위, 소장(십이지장, 공장 및 회장), 대장(맹장 및 결장)을 구분하여 채취한 다음 10% 중성완충포르말린에 고정하여 일반적인 조직처리 방법에 따라 파라핀 포매하여 3-4 μm 두께로 절편을 제작한 후 hematoxylin과 eosin 염색을 실시하여 광학현미경으로 검경하였다.
병리조직학적 검사가 수행된 총 153마리의 돼지 중 사후변화와 인위적 손상(artifact)이 수반되지 않은 124마리의 소장 조직에서 융모의 위축 정도를 수치화하기 위하여 융모의 높이(villous height, VH)와 움의 깊이(crypt depth, CD)를 비교하였다. 특히 광학현미경 40배 시야에서 무작위로 선정한 공장과 회장, 각 10개 부위를 측정하여 평균 및 표준편차를 산출하였으며, 이를 토대로 VH와 CD의 비율을 산정하였다. 또한 바이러스 감염으로 인해 손상 받은 융모가 서로 융합하는 정도를 세분하여 분류하였다. 공장 및 회장을 광학현미경으로 관찰하였을 때, 100배 시야에서 융모 융합의 정도가 10% 미만일 경우 focal (G1), 10-50%는 multifocal (G2), 50% 이상은 diffuse (G3)로 구분하였다.
총 153마리 중 사후변화와 인위적 상피 탈락이 동반되어 있지 않은 개체인 126마리의 공장과 120마리의 회장을 대상으로 소장 점막상피세포의 변화상을 좀 더 면밀히 관찰하고 세분하여 기록하였다. 광학현미경 100배 또는 200배 시야에서 융모상피세포의 탈락(exfoliation), 편평화(squamation) 및 세포질의 공포화(vacuolation)의 정도에 따라 10% 미만인 경우 focal (G1), 10-50%는 multifocal (G2), 50% 이상은 diffuse (G3)로 구분하였다. 또한 병리조직학적 병변도 육안 병변과 마찬가지로 돼지의 연령에 따라 4일령 미만, 4일 이상 7일 이하, 8일 이상으로 세분하여 발생 빈도를 비교하였다.
면역조직화학 검사
의뢰된 돼지 시료 중 심한 사후변화가 진행된 것을 제외하고 135마리의 공장, 127마리의 회장 및 133마리의 결장에서 대하여 PEDV 항원의 분포를 확인하기 위하여 면역조직화학(immunohistochemistry, IHC) 검사를 수행하였다. 파라핀 조직을 4-5 μm 두께로 박절하여 silane 코팅 슬라이드에 부착하고 탈파라핀 및 함수과정을 거쳤다. 조직 슬라이드를 3% H2O2가 첨가된 phosphate buffered saline (PBS, pH 7.2)에 10분간 반응하고, 항원성의 부활을 위해 citrate buffer solution으로 97℃에서 60분간 반응하였다. 1차 항체로는 mouse monoclonal anti-PEDV antibody (Median Diagnostics, Korea)를 1:500배로 희석한 다음 조직절편에 적하하여 37℃에서 1시간 반응하였다. 2차 항체로 EnVision/horseradish peroxidase, rabbit/mouse reagent (Dako, Denmark)를 슬라이드에 적하하여 37℃에서 40분간 반응하였다. 각 단계별로 반응 후에는 PBS로 5분씩 2회에 걸쳐 수세하였다. 모든 반응이 끝난 절편은 3,3‘-diamino-benzidine tetrahydrochloride (Dako)로 발색시킨 후, 3차 증류수에서 반응을 종결하였다. 대조염색은 Mayer's hematoxylin (Sigma, USA)으로 염색하였으며, 탈수와 투명과정을 거쳐 봉입하였다.
면역염색이 끝난 조직 내 PEDV 항원의 발현 정도는 기존의 보고를 토대로 3등급(expression grade, EG)으로 세분하여 평가하였다[8]. 즉, 광학현미경 200배 시야에서 공장, 회장 및 결장 점막상피세포에서 PEDV 항원이 전체 상피세포의 10% 미만에서 발현되는 경우 국소적(focal, EG1), 10-50%는 다병소성(multifocal, EG2), 50% 이상은 미만성(diffuse, EG3)으로 구분하였다.
병원체 검사
검사시료의 RNA 추출
설사 유발 병원체를 검사하기 위하여 총 153두의 돼지 대장에서 무균적으로 분변을 채취 후 -70℃에 보관하여 바이러스검사에 활용하였다. RNA 바이러스인 PEDV 및 TGEV에 대한 RT-PCR을 실시하였다. 유전자검사를 위하여 분변시료를 DNase RNase free distilled water (Invitrogen, USA)와 1:10 비율로 혼합하여 상층액을 이용하였다. RNA 추출은 RNeasy Mini kit (QIAGEN GmbH, Germany)를 이용하여 제조사가 제시한 실험방법에 준하여 실시하였다.
RT-PCR 반응 조건
RT-PCR은 PEDV 및 TGEV를 검출하기 위한 primer가 함유되어 있는 제품화된 premix인 i-TGEV/PEDV detection kit (Intronbiotechnology, Korea)에 추출한 RNA 2 μL 및 DNase RNase free distilled water (Invitrogen) 18 μL를 분주하였으며, 제시된 실험방법에 준하여 수행하였다.
RT-PCR 증폭산물의 확인
반응 종료 후, 각각의 반응액 8 μL씩을 1.5% agarose gel 상에서 전기영동을 실시한 다음 RedSafe nucleic acid staining solution (Intronbiotechnology) 용액(0.5 μL/mL in distilled water)으로 염색하였다. Ultraviolet transilluminatior로 각각의 유전자에 대한 특이적인 밴드 유무를 확인하였다.
PEDV의 유전학적 검사
제주도 돼지 시료에서 검출된 PEDV 중 12주(2014년 8주: KOR/JJ-1-8/2014, 2015년 4주: KOR/JJ-1-4/2015)에 대한 유전학적 검사를 실시하였다. PEDV spike (S) 유전자 검출을 위한 primer는 Chen 등[9]의 방법에 따라 제작하였다. PEDV RNA는 설사 분변이나 소장 조직으로부터 TRIzol LS (Invitrogen Corp., USA)를 이용하여 추출하였다. RT-PCR은 RT 단계는 50℃에서 30분, pre-cycle heating 단계는 95℃에서 5분, cycle reactions 단계는 94℃에서 30초, 52℃에서 2분 30초, 72℃에서 1분 30초간 35 cycles를 수행한 후 증폭된 산물을 pGEM-T vector system II (Cat. No. A3610; Promega Corp., USA)를 이용하여 클로닝하였다.
PEDV 유전자를 분석하기 위하여 클로닝된 유전자를 T7과 SP6 sequencing primer를 이용하여 마크로젠(Macrogen, Korea)에 ABI Prism 3730xi DNA sequencer로 유전자 염기서열을 판독하였으며, 판독된 S 유전자들을 나열하기 위해 CLUSTALX alignment program과 BIOEDIT 7.053 program을 사용하여 분석하였다.
이후, 유전자검사 결과를 토대로 계통학적 트리를 만들기 위해 Mega ver. 6.0 (Mega Software, USA) 내에 들어있는 neighbor-joining method를 사용하였다[10].
통계 처리
IHC 검사를 통한 개체별 PEDV 항원의 발현 등급(EG)인 EG1, EG2, EG3를 각각 1, 2, 3으로 수치화하여 합한 다음 전체 개체수로 나누어 평균 항원 발현 등급과 표준편차를 산출하였다. 돼지 공장, 회장 및 결장 조직 내 PEDV 항원의 발현 정도에 유의성 있는 차이가 있는지를 확인하기 위하여 IBM SPSS Statistics ver. 25.0 (IBM Corp., USA)을 사용하여 ANOVA test로 통계분석을 실시하였으며, p < 0.05일 때 유의한 차이가 있는 것으로 간주하였다.
결과
제주도 내 PED 진단 현황
제주도에서 2014년 4월부터 18개월 동안 PED로 진단된 예는 총 153마리로 확인되었다. 돼지의 연령별로는 4일령 미만이 101마리(66.0%), 4-7일령 43마리(28.1%) 및 8일령 이상 9마리(5.9%)로 확인되었다. 이 중, 8일령 이상 돼지는 9일령 2마리, 10일령, 14일령, 15일령, 및 17일령이 각각 1마리, 21령 3마리로 구분되었다.
제주특별자치도 가축통계조사 자료에 따르면, 2014년 현재까지 제주도 내 전체 양돈 농가수는 304호이며, 행정시 별로는 제주시 214호, 서귀포시 90호로 나타나 있다. PED가 진단된 양돈 농가는 총 52호로 전체 농가 중 약 17.1%에 달하였다. 지역별로는 제주시 19.6% (42/214), 서귀포시 11.1% (10/90)로 나타나 제주시에서의 PED 발생이 더욱 높은 것으로 확인되었다. 발생 농가를 읍, 면별로 세분하여 살펴보았을 때, 제주도의 서부지역에 해당하는 한림읍 29.9% (41/137), 대정읍 27.8% (10/36), 한경면 4.2% (1/24)에 국한되어 발생하고 있었다.
검사 기간 동안 동일한 농장에서 여러 차례 검사 의뢰된 경우를 포함하여 PED로 진단된 예는 총 72건(153마리)이었다. 이를 월별로 세분하여 PED 발생을 분석한 결과, 2014년 4월 13건(18.1%), 5월 14건(19.4%), 6월과 7월이 각각 1건(1.4%), 8월 3건(4.2%), 9월 4건(5.6%), 10월 1건(1.4%), 11월과 12월 2건(2.8%), 2015년 1월 9건(12.5%), 2월 5건(6.9%), 3월 6건(8.3%), 4월 1건(1.4%), 5월 3건(4.2%), 6월과 7월 1건(1.4%), 9월 5건(6.9%)으로 나타났다(Table 1). 따라서 제주도 내 최초 재발생 시점인 2014년 4월과 5월에 폭발적인 발생을 보이다가 하절기에 소강상태로 접어들었으나, 이후 동절기에 들어서면서 다시 증가하는 양상을 보이고 있었다.
확진된 52호 농가를 의뢰 유형별로 분석한 결과 1회 검사 의뢰 농가는 35농가(67.3%)였으며, 2회, 3회 및 4회 의뢰 농가는 각각 15농가(28.8%), 1농가(1.9%) 및 1농가(1.9%)로 나타났다.
육안검사 결과
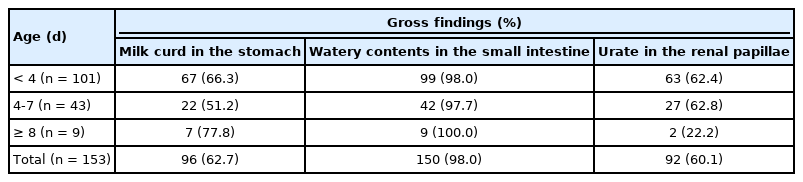
육안적으로 PED로 확진된 돼지는 현저하게 위축되어 늑골이 노출되고, 일부 개체는 안구가 함몰되어 있었다. 항문 주위 피부에는 담황색 또는 황색의 수양성 변내용물이 부착되어 있었다(Fig. 1A). 위 내에는 소화되지 않은 유백색의 응유가 다량 들어있었다. 소장은 담색조로 퇴색되어 있거나 무력하였으며, 장벽이 현저하게 얇아져 장강 내의 수양성 내용물이 명료하게 관찰되었다(Fig. 1B). 소장 장막과 장간막의 혈관 및 림프관의 관찰은 용이하지 않았다. 상당수 개체의 대장 내강에도 황색의 수양성 내용물이 충만되어 있었다. 신장의 단면상에서는 유두부 또는 신우 부위에 황갈색의 요산염이 침착되어 있었으며(Fig. 1C), 일부 개체의 방광 내에서도 관찰할 수 있었다.

Gross findings. (A) Note yellowish watery feces (arrow) around the anus in suckling piglet. (B) Small intestine. Note thin and transparent intestinal wall (arrows), and yellowish watery contents in the lumen. (C) The kidney. Note the yellowish-brown materials (urate crystal, arrows) in the renal papillae.
확진된 153마리 돼지에서 소장 내 수양성 내용물의 저류(98.0%)가 위 내 응유의 존재(62.7%) 및 신장의 요산염 침착(60.1%)에 비하여 높은 빈도로 관찰되었다(Table 2). 돼지의 연령별로는 큰 차이를 보이지는 않았지만, 신장의 요산염 침착은 8일령 이상의 돼지에서 현저하게 낮았다.
병리조직학적 검사 결과
병리조직학적으로 소장의 점막층에서 가장 특징적인 변화상이 관찰되었으며, 점막하직, 근육층 및 장막에서는 특별한 병변을 관찰할 수 없었다. PED로 확진된 돼지의 소장에서 가장 두드러진 병리조직학적 병변은 융모의 현저한 위축과 융합이었다. 공장과 회장에 대하여 VH:CD 비율을 비교한 결과 공장(1.4:1)이 회장(1.5:1)에 비하여 다소 낮게 나타났으며, 다른 연령에 비하여 4-7일령의 돼지들이 공장과 회장 모두에서 1.3:1로 가장 낮았다(Table 3).
바이러스 감염에 따른 소장 융모의 위축뿐만 아니라, 손상 받은 융모가 서로 융합하는 병변도 자주 관찰되었다. 부위별로는 공장(72.6%, 90마리)보다는 회장(78.2%, 97마리)에서 융모의 융합이 더욱 빈번하게 관찰되었다(Table 4). 또한 심한 병변 등급인 G3가 공장(50.0%, 62마리)과 회장(54.0%, 67마리)에서 모두 높게 관찰되었다.
Histopathologic grade for the villous fusion of the small intestine from 124 piglets according to ages
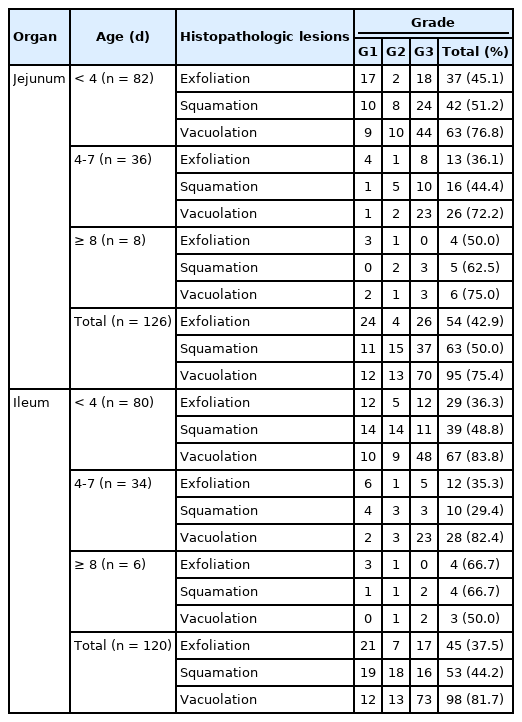
또한 융모상피세포의 미세융모 소실, 입방화(Fig. 2A), 편평화(Fig. 2B), 상피세포의 세포질에 하나 또는 여러 개의 투명한 공포 형성(Fig. 2C) 및 상피세포 탈락(Fig. 2D)이 관찰되었다. 일부 개체에서는 움의 장선이 호염성으로 농염되어 있고, 술잔세포가 거의 소실된 재생의 흔적이 존재하고 있었다. 그러나 고유층에서의 염증 반응은 거의 없거나 매우 미약하였다. 신장 수질부의 원위곡세뇨관 또는 집합관 내강에 호산성의 과립상 물질인 요산이 자주 관찰되었다. 공장 126마리 및 회장 120마리에서 관찰된 융모상피세포의 특징적 병변들을 비교하였다(Table 5). 이 중 세포질에 공포 형성 병변이 가장 높은 비율로 관찰되었고 편평화 및 상피 탈락 순으로 나타났다. 특히 세포질의 공포화는 G3 등급 비율이 가장 높았고, 공장(75.4%, 95마리)보다는 회장(81.7%, 98마리)에서 더욱 빈번하게 확인되었다. 상피세포의 탈락은 공장과 회장 모두에서 G1 또는 G3 비율이 높은 반면, 편평화 병변은 공장에서의 G3 비율이 회장에 비하여 높게 관찰되었다. 돼지의 연령별 비교하면, 공장에서는 돼지의 일령에 상관없이 상피세포의 공포화가 가장 많이 관찰되었으며 편평화 및 상피세포탈락 순으로 나타났다. 공포화와 편평화 병변은 G3 등급이 많은 빈도를 차지하는 반면, 상피세포의 탈락 병변은 등급별로 비교적 다양하게 관찰되었다. 회장의 경우 4일령 미만 및 4-7일령의 돼지에서는 상피세포의 공포화가 가장 많이 관찰되는데 비하여, 8일령 이상에서는 뚜렷한 차이를 나타내고 있지 않았다. 또한 공포화 병변은 4일령 미만 및 4-7일령의 돼지에서 G3등급 발현이 높게 나타났다.

Note the characteristic histopathologic porcine epidemic diarrhea virus lesions (arrows) in the small intestine. (A) Cuboidalization, (B) squamation, (C) cytoplasmic vacuolation, and (D) epithelial exfoliation of the enterocytes. (A-D) H&E, scale bar: 50 μm.
면역조직화학 검사 결과
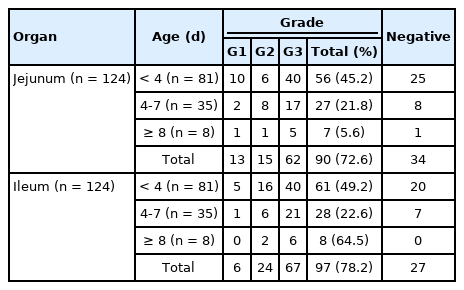
소장에서 PEDV 항원은 대부분 위축된 융모 또는 점막을 피복하고 있는 공포화 및 입방화가 진행된 상피세포의 세포질 또는 솔변연에서 발현되고 있었으며(Fig. 3A and B), 일부 탈락 상피 또는 움 상피세포에서도 항원을 관찰할 수 있었다. 조직학적으로 항원은 EG1 또는 EG2로 분포하거나 심한 경우 EG3의 분포를 보이기도 하였다(Table 6). 그러나 점막고유층, 점막하직 및 기타 근육층에서는 바이러스 항원을 검출할 수 없었다. 특히 PEDV의 표적장기가 아닌 것으로 알려져 있는 결장의 점막상피세포에서도 바이러스 항원이 검출되기도 하였으며(Fig. 3C), 소장과 달리 국소적인 분포를 보이고 있었다.
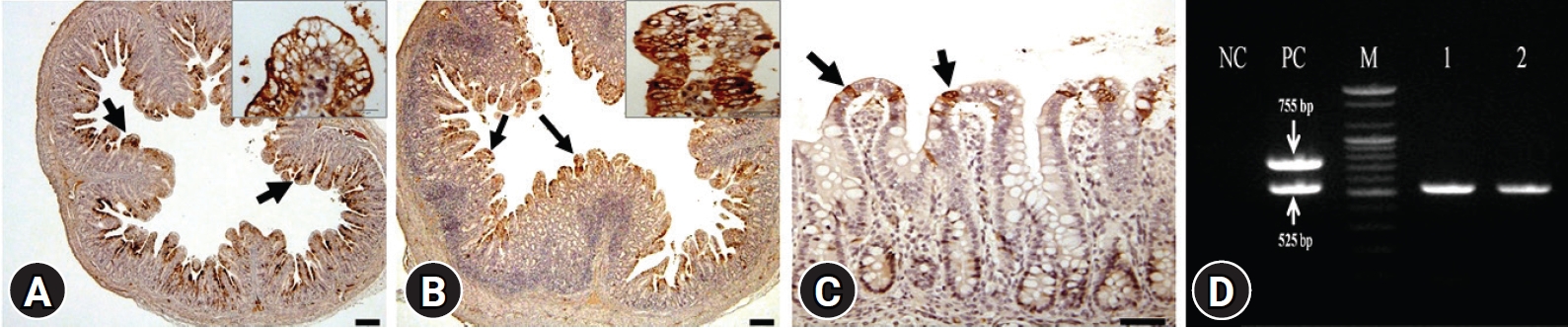
Expression of the porcine epidemic diarrhea virus (PEDV) antigens (arrows) in the cytoplasms of the intestinal enterocytes. (A) Jejunum (immunohistochemistry [IHC], scale bar: 200 μm). Higher magnification of enterocytes (insert) (IHC, scale bar: 20 μm). (B) Ileum (IHC, scale bar: 200 μm). Higher magnification of enterocytes (insert) (IHC, scale bar: 20 μm). (C) Colon (IHC, scale bar: 100 μm). (D) Reverse transcription polymerase chain reaction products of PEDV. NC, negative control; PC, PEDV (525 bp) and transmissible gastroenteritis virus (755 bp) positive control; M, 100 bp ladder; lanes 1 and 2, fecal samples.
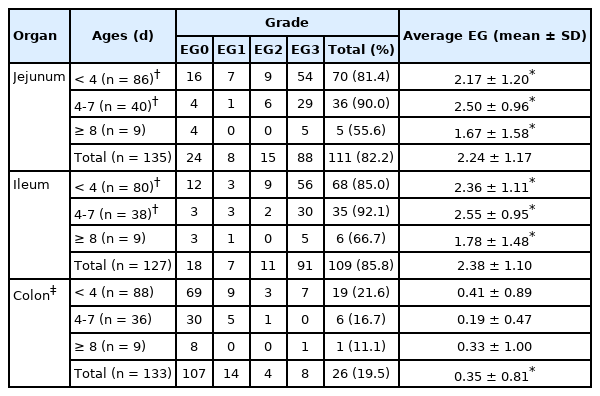
Expression grade of porcine epidemic diarrhea virus antigen in small and large intestine according to piglet ages
바이러스 항원 발현은 회장(85.8%, 109마리)이 공장(82.2%, 111마리)에 비하여 높게 나타났다(Table 6). 전체적으로 소장 조직에서는 EG3 등급의 항원 발현 개체가 80% 이상을 점유하고 있었다. 결장의 경우 검사한 133마리 개체 중 19.5% (26마리)에서 항원이 검출되었다. 각 장기별로 평균 항원 발현 등급을 비교한 결과, 공장과 회장이 결장에 비해서 유의성 있게 높은 수준으로 발현되었다(p < 0.05). 항원의 발현을 돼지의 연령별로 비교한 결과(Table 5), 4-7일령의 돼지 공장(90.0%, 36마리)과 회장(92.1%, 35마리)에서 가장 많이 검출되었다. 반면 8일령 이상 돼지의 공장(55.6%, 5마리)과 회장(66.7%, 6마리) 모두에서 현저하게 감소하는 경향을 보이고 있었다. 또한 공장 및 회장의 PEDV 평균 항원 발현 등급을 연령별로 비교한 결과에서도 8일령 미만의 돼지가 8일령 이상 돼지의 발현 등급보다 유의성 있게 높게 나타났다(p < 0.05).
결장의 경우 4일령 미만 19마리, 4-7일령 6마리 및 8일령 이상 1마리 등 총 26마리의 돼지에서 PEDV 항원이 검출되었다.
병원체 및 유전학적 검사 결과
돼지 분변에 대한 RT-PCR 검사 결과, PEDV 및 TGEV 유전자 증폭산물이 각각 525 bp 및 755 bp에서 검출되었다(Fig. 3D). TGEV는 전 개체 음성이었으며, PEDV는 151마리(98.7%)에서 양성 반응을 보였으나 나머지 2두(3 및 4일령)는 음성으로 확인되었다.
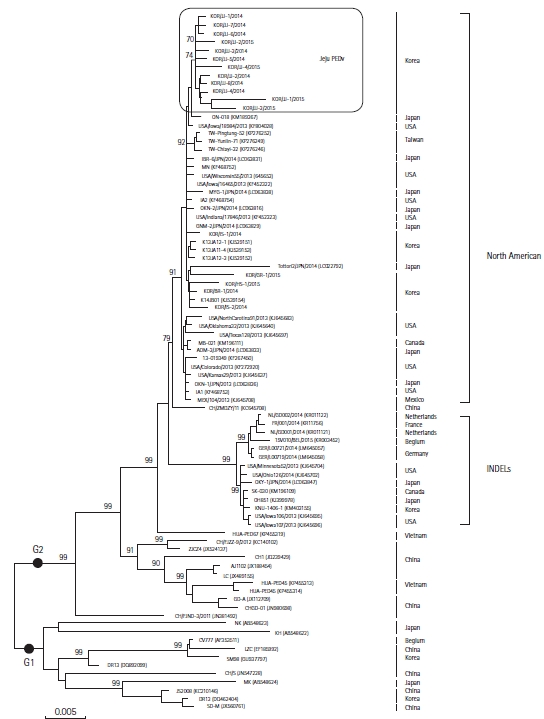
제주도에서 검출된 12주의 PEDV S 유전자를 분석한 결과 각 분리주간에 98.9% 이상의 상동성을 보이고 있었다(Fig. 4). 또한 계통학적 트리를 작성한 결과, 분리된 PEDV는 genogroup 2 (G2)에 속하여 있음이 입증되었다(Fig. 5). 최근 미국에서는 병원성이 경미한 insertions and delections in the spike gene (INDELs) 그룹 PEDV와 병원성이 강한 North American 그룹 PEDV 2종이 분리되었으며[11], 이번 연구에서 분석한 12주의 PEDV는 모두 North American 그룹에 속하고 있음을 확인할 수 있었다.
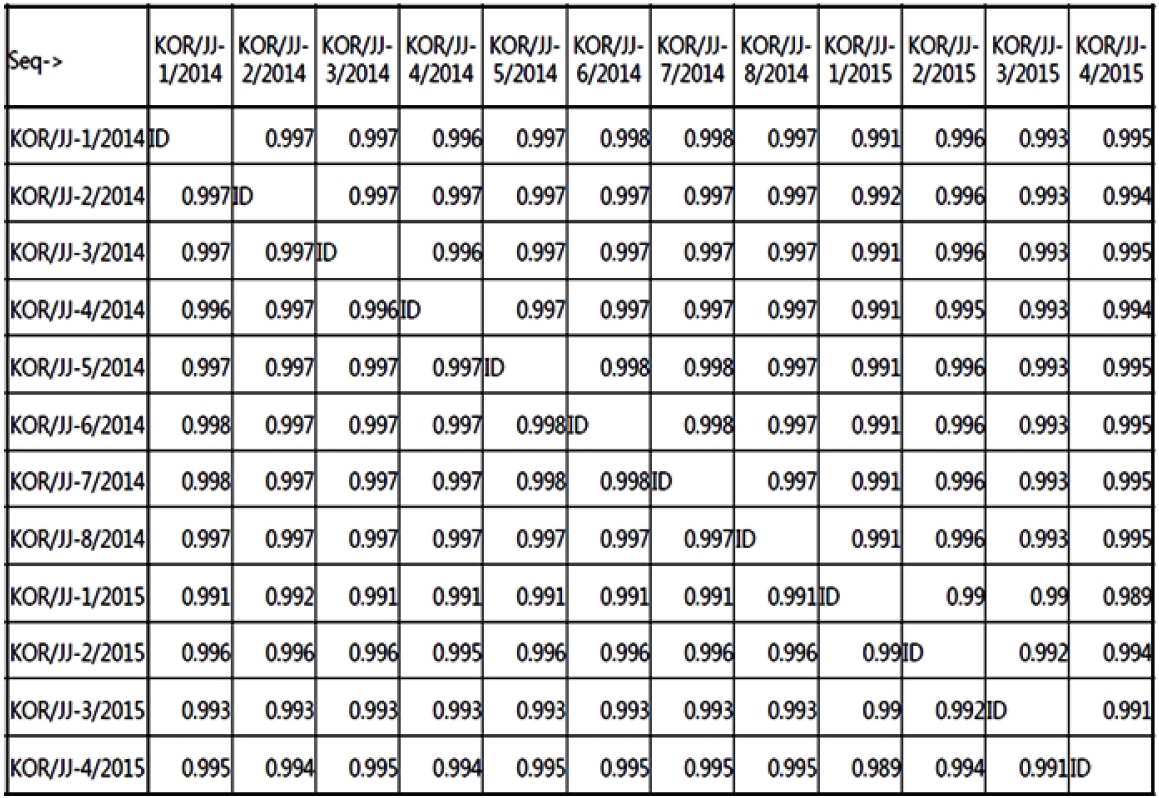
Nucleotide sequence homology for the spike gene of 12 porcine epidemic diarrhea virus strains in Jeju.
고찰
뚜렷한 동절기의 계절 발생을 보이는 TGE와는 달리 과거 국내에서 유행하던 PED는 거의 연중 발생하였지만, 대체로 동절기에 해당하는 기간이 11월에서 3월까지 집중하여 발생하는 경향을 보이고 있었다[5]. 이번 연구를 통해 제주도 내에서 PED는 재발생 시점에 폭발적인 발생이 있은 후 거의 계절에 관계없이 연중 발생하다가 동절기에 들어서면서 증가하는 경향을 보이고 있었다. 또한 PED 발생 52농가 중 17개(32.7%) 농가에서 2회에서 많게는 4회까지 지속 발생하는 양상을 나타내고 있었다. 더욱이 양돈 농가가 밀집되어 있는 제주도 서부지역(한림읍, 대정읍 및 한경면)에서 집중적으로 발생하고 있었다. 이러한 점은 농장 간의 질병 전파를 예방하기 위한 차단방역이 제대로 수행되고 있지 않을 뿐만 아니라, 농장에서의 부실한 예방접종, 질병 발생 농장의 인공 면역 실시 또는 부적절한 환돈 관리 등이 지속적 PED 발생의 원인으로 추정되고 있다. 과거 국내 양돈장을 대상으로 실시한 PED 역학 조사 결과에 따르면, PEDV의 농장 내 순환 감염의 원인으로 분만사 환돈에 대한 부적절한 조치, 부적절한 예방접종에 따른 모돈의 면역 수준 불균형, 유즙불량 모돈에서 자돈으로 초유항체 전달 실패, 모돈수 과다에 따른 분만사 공간 부족 등으로 분석된 바 있다[12].
PEDV는 돼지의 소장 특히, 공장 및 회장의 융모상피세포에 감염되어 융모의 위축을 초래하여 흡수불량성 설사를 유발한다. PEDV 감염 시 육안적으로 소장은 팽윤되고 황색의 수양성 내용물을 함유하고 있으며, 병리조직학적으로는 VH:CD 비율이 정상범위인 7-8:1에서 3:1까지 감소하는 것으로 알려져 있다[2]. 국내에서는 PED 감염이 처음으로 확인된 1992-1993년 사이 총 71건을 검사한 결과 공장 및 회장에서 VH:CD 비율이 평균 3:1-2:1 정도로 감소하였으며, 심한 예에서는 1:1에서 1:2까지 현저하게 위축되기도 하였다[5]. 최근 2013년 미국에서는 PED로 확진된 자돈의 장내용물에서 분리된 PEDV를 10-35일령 무균돼지에 경구감염시킨 결과 접종 24-48시간 후 심한 설사 및 구토 증상을 보였으며, 소장에서 VH:CD 비율이 개체별로 1.2-3.4:1 정도로 심한 융모의 위축을 보였다고 하였다[6]. 이번 연구에서 제주도 돼지의 경우 공장과 회장의 평균 VH:CD 비율이 각각 1.4:1 및 1.5:1로 나타났으며, 특히 4-7일령 자돈의 공장과 회장 모두에서 1.3:1로 가장 낮게 나타났다. 또한 위축된 융모의 융합 소견도 심한 등급인 G3의 비율이 50% 이상의 돼지 공장 및 회장에서 관찰되고 있었다. 따라서 과거 국내에서 발생한 PEDV에 비하여 최근 제주도에서 발생하고 있는 PEDV의 병원성이 좀 더 강할 것임을 간접적으로 시사하고 있는 것으로 추정된다.
PEDV에 감염된 돼지의 소장에서는 병리조직학적으로 장 융모의 위축과 함께 상피세포의 탈락 및 세포질 내 공포 형성 소견이 특징적으로 나타난다[2,6]. 과거 국내 발생한 PED 감염 돼지에서 병리조직학적 소견은 십이지장보다는 공장과 회장에서 주로 병변이 관찰되었다. 융모상피세포의 세포질에 무수히 많은 작은 공포가 형성되어 있고, 원주상피세포의 높이가 낮아져 입방화되거나 심한 경우 편평하게 되었으며, 때로 상피세포가 박리되어 점막고유층이 노출되어 있기도 하였다[5,13]. 본 연구에서 병리조직학적 소견의 발생 빈도를 살펴보았을 때, 세포질 내 공포 형성, 상피세포의 입방화 또는 편평화 및 탈락의 순으로 나타나고 있었다. 또한 심한 개체에서는 미세융모의 소실 또한 관찰되었다. 그러므로 PEDV 감염에 따른 융모의 위축, 상피세포의 공포화 및 이에 따르는 일련의 변화로 인하여 소장에서의 흡수 기능은 현저하게 떨어지게 되어 심한 흡수불량성 설사와 함께 탈수를 유발하고 특히 어린 돼지에서 높은 폐사율을 보이게 된다.
IHC 검사 결과 공장과 회장에서 광범위하게 상피세포에서 PEDV 항원이 발현되었으며 공장(82.2%)보다는 회장(85.8%)에서 높게 발현되고 있었다. 비록 검사한 돼지의 결장에서 병리조직학적 병변은 거의 관찰되지 않았지만, 19.5%의 결장에서도 국소적이지만 PEDV 항원을 검출할 수 있었다. 과거 연구에 따르면, PEDV에 자연감염되거나 인공감염시킨 돼지에서 소장의 융모상피세포와 결장 점막에서 형광항체검사를 이용하여 바이러스 항원을 검출한 바 있다[2]. 이에 반하여 과거 국내 또는 일본에서 발생한 PED의 경우 결장에서는 바이러스가 검출되지 않거나 아주 약하게 검출되었다[14,15]. 그러나 최근 2013년 미국에서 PEDV를 실험감염시킨 돼지에서는 5마리 전 두수에서 맹장 및 결장에서 항원이 검출된 바 있다[6]. 따라서 이번 제주도에서 발생한 PED는 과거 국내에서 발생한 PED와 장 조직 내 바이러스 항원의 분포가 다르며, 결장 내 항원의 존재는 일정 정도 돼지의 설사를 비롯한 임상증상을 더욱 심하게 만드는 요인으로 작용되었을 것으로 추정된다.
PED의 임상증상, 병리해부학적 및 병리조직학적 소견은 TGE와 매우 유사하기 때문에 두 질병에 대한 감별진단은 매우 중요하다[2,6,13]. 두 질병을 감별하기 위한 진단기법으로는 형광항체검사법, IHC, 전자현미경 검사법, 바이러스분리기법, 효소결합면역흡착측정(enzyme-linked immunosorbent assay) 기법, RT-PCR 등이 활용되고 있다. 본 연구에서 돼지 분변 153점을 대상으로 RT-PCR 검사를 수행한 결과, 151마리가 PEDV 양성이었으나, 나머지 2마리는 음성을 나타내었다. 그러나 이 두 마리 돼지들은 병리조직학적으로 소장 융모의 위축과 융합 및 상피세포의 병변이 있었을 뿐만 아니라, IHC 검사 결과 PEDV 항원 양성으로 판명되었다. 따라서 돼지에 바이러스가 감염된 후 소장 융모상피세포에 손상을 주기는 하였으나, 세포 내에서 충분한 양의 바이러스 증식이 이루어지지 않아 분변으로 바이러스 배출이 적거나 없었던 감염 초기 단계의 개체로 해석될 수 있을 것으로 판단된다. PEDV의 원형으로 받아들여지고 있는 CV777 분리주를 경구로 인공감염시킨 돼지에서 형광항체검사법을 이용하여 바이러스 항원을 검사한 결과 감염 후 약 12-18시간에 소장 상피세포에 감염이 이루어지고 24-36시간에 최대치에 달하며, 이후 바이러스의 증식과 함께 상피세포의 변성과 융모의 위축이 발생한다[2]. 최근 미국형 PEDV를 인공감염시킨 돼지의 경우 감염 후 24-48시간 후에 분변을 통해 바이러스가 배출되었다고 하였다[6]. RT-PCR 검사기법은 PEDV와 TGEV를 감별진단하기에 매우 용이하고 민감한 진단기법이기는 하지만, 분변 내 바이러스 배출이 매우 적은 감염 초기 또는 말기에는 검출되지 않을 개연성이 있다. 또한 IHC 기법은 병리조직학적 병변의 관찰과 함께 조직 내 바이러스의 유무까지 확인할 수 있는 매우 유용한 진단기법으로 증상 발현 후 2일 이내의 급성기 돼지의 장 조직 시료에 적용할 수 있다. 특히 설사 증상을 보이는 개체의 신선한 조직 또는 분변이 없는 상황에서 포르말린 고정 조직만이 있을 경우 IHC 기법은 PEDV 검출을 위해 유용하게 적용될 수 있다. 그러나 IHC 기법도 사후변화가 심하게 진행되어 있거나, 상피세포의 탈락이 현저한 소장에는 진단법 적용에 제한이 따른다. 따라서 바이러스의 감염 시기와 감염량, 감염된 돼지의 병변 정도, 검사에 활용할 수 있는 시료의 종류와 보관 상태 등에 따라 진단기법의 적용에 제한이 따를 수 있기 때문에, RT-PCR과 IHC 기법을 병용하여 활용하면 좀 더 정확한 PED 진단이 이루어질 수 있을 것으로 생각된다.
과거 풍토병성 PED로 인한 영향은 그리 크지 않았으나, 2010년 10월 중국 남부 지역 포유 자돈에서 80-100%에 달하는 높은 폐사율을 보이는 PED가 발생한 이후 다른 아시아 국가들로 급속히 전파되었으며[16], 미국에서는 2013년 5월 아이오와주에서 본 질병이 최초로 발생한 후 전국으로 확산되었다[6]. 국내에서도 2013년 말부터 충청남도와 경상남도 지역에서 PED가 잇달아 발생한 후 전국적으로 확산된 상황이다. 제주도는 국내 내륙지역과 분리되어 있는 섬이라는 특수성을 가지며, 2002년 4월부터 악성 돼지질병 청정화를 달성하여 다른 지역으로부터 돼지 생축 및 돼지고기의 반입이 전면 금지되어 있고, 일부 수입육 등에 한해서만 반입이 허용되고 있는 상태이다. 따라서 2014년 4월 이후 발생하고 있는 제주도 내 PED의 경우 가축 등에 의한 전파보다는 타시도에서 출입하는 축산관계자, 차량 등에 의한 기계적 전파에 의해 유입되었을 가능성이 높은 것으로 추정되고 있다.
과거 국내에서 분리된 PEDV는 CV777 분리주와 매우 유사한 것으로 알려져 왔다[4]. 그러나 최근 농림축산검역본부 연구에 따르면, 한국 내륙지역의 양돈 농가 돼지 설사 분변에서 분리한 바이러스 2010년 8개, 2012년 및 2013년 9개 등 총 17주의 PEDV의 S, open reading frame 3 (ORF3), envelope (E), membrane (M), nucleoprotein (N) 유전자에 대한 염기서열을 분석하여 분자생물학적 특성을 조사하였다[17]. 그 결과 국내 PEDV는 각 유전자별로 크게 2개의 그룹(G1 및 G2)으로 나뉘었다. PEDV S 유전자의 경우 크게 백신주가 속한 그룹(G1)과 대부분의 야외주가 속하는 그룹(G2)으로 나뉘고, G2는 다시 G2-1과 G2-2로 세분되며, 국내분리주간의 상동성은 최대 10% 이상 차이를 나타내고 있었다. 또한 시판되고 있는 백신주와 국내분리주간 각 유전자별 상동성 분석결과 ORF3, E, S, N, M 순으로 상동성이 낮았으며, S 유전자의 경우 91.8-99.3% (90.0-98.9%)로 약 10%의 차이를 나타내고 있었다. 더욱이 해외에서도 2010년 이후 중국 및 북미 등지에서 발생한 PEDV는 서로 상동성이 높고 병원성이 강하여, 2010년 이전의 PEDV와 유전적 및 병원성의 차이가 있었다[18,19]. 이러한 PEDV의 변이로 인하여 국내를 비롯한 외국에서도 기존에 사용하고 있던 백신의 방어 효과에 대한 문제점이 제기되고 있는 실정이다. 따라서 각국에서는 최근 발생하고 있는 PED에 대한 신속 정확한 진단기법의 확립뿐만 아니라 질병 발생 기전 및 유효성이 있는 백신 개발 등의 연구에 박차를 가하고 있다[20,21].
이번 연구에서 분리된 총 12주의 PEDV S 유전자를 대상으로 염기서열을 분석한 결과 각 바이러스의 상동성은 98.9-99.8%에 달하는 것으로 확인되었다. 따라서 제주지역에서 10년 만에 PED가 재발생하였지만, 거의 유전적으로 동일한 바이러스가 돼지에게 전파되고 있는 것으로 생각된다. 또한 PEDV에 대한 계통학적 트리를 작성한 결과 이들 바이러스는 모두 2013-2014년 한국 내륙에서 발생한 PEDV [22] 및 북미형 PEDV에 속하는 G2 그룹에 속하였다. 한편 국내 내륙에서 분리된 PEDV의 일부는 같은 G2 그룹에 속하지만 병원성이 비교적 약한 것으로 알려져 있는 INDELs 그룹에 속하는 것으로 밝혀졌으나[11], 이번 제주에서 검출된 12주의 PEDV는 INDELs 그룹과는 동질성에 차이가 있는 것으로 확인되었다. 최근 Lee 등[23]은 2018년에 제주에서 분리된 PEDV를 G2b PEDV와 비교 분석한 결과 S 유전자 및 전체 유전체 수준에서 각각 96.7-98.7% 및 98.5–99.4% 상동성을 보였다. 따라서 유전적 및 계통 발생학적으로 2018년에 제주에서 분리된 PEDV가 기존 2014년 제주 PEDV와 상동성 높기는 하지만 시간이 지날수록 상동성이 낮아지고 있어 바이러스가 진화하고 있음을 시사하였다. 따라서 제주에서 문제시되고 있는 PEDV와 국내 내륙지역에서 발생하고 있는 PEDV와의 병원성의 차이 및 바이러스의 유연 관계를 비교 분석하는 연구와 함께 적절한 백신주의 선별 및 효과적인 백신 개발을 통하여 PED로 인한 양돈 농가의 피해를 최소화하는데 노력을 경주해야 할 것으로 판단된다.
Notes
The authors declare no conflict of interest.
Acknowledgements
본 논문은 농림축산검역본부 학술연구용역과제(Z-1543083-2017-18-01) 연구비를 지원받아 수행되었으며, 이에 감사드립니다.